
科目: 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如下:

已知:
回答下列问题:
(1)A的结构简式是___________,E的化学名称是____________。
(2)由B生成C的化学方程式为______________________。
(3)G的结构简式为__________________。合成丁苯酞的最后一步转化为:
 ,则该转化的反应类型是_______________。
,则该转化的反应类型是_______________。
(4)有机物D的溴原子被羟基取代后的产物J有多种同分异构体,其中含有苯环的同分异构体有______种(不包括J),其核磁共振氢谱吸收峰最多的结构简式为_________。
(5)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.用溴水即可鉴别苯酚溶液、2,4﹣己二烯和甲苯
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.用甘氨酸(![]() )和丙氨酸(
)和丙氨酸(![]() )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
查看答案和解析>>
科目: 来源: 题型:
【题目】用中和滴定法测定某烧碱的纯度。将2.5g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成250mL溶液。根据实验回答下列问题:
I.滴定前的准备
检漏→用蒸馏水清洗→用待装溶液润洗→装液→①→调节液而在“0”刻度或“0”刻度以下→记录初始读数
II.滴定
分别取20.00mL待测液于3个洁净的锥形瓶中,滴加2滴酚酞试液,然后用0.2000mol·L-1盐酸标准液进行滴定至终点,记录最终读数。数据如下:
滴定序号 | 待测液体积(mL) | 滴定前(mL) | 滴定后(mL) |
1 | 20.00 | 0.50 | 20.70 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 5.00 | 25.10 |
III.实验数据处理
(1)将步骤I中的操作补充完整:
①___________
(2)如图所示为___________ (填“酸式”或“碱式”)滴定管的一部分,若该滴定管漏水或转动不灵活,可采取的措施是___________
(3)滴定终点的现象是_______
(4)计算:NaOH溶液的浓度为_______mol·L-1烧碱样品的纯度为________
(5)试判断以下几种情况对烧碱纯度测定结果的影响(填“偏大”、“偏小”或“无影响”)
①若用蒸馏水冲洗锥形瓶,使测定结果_____________
②若滴定前滴定管尖嘴有气泡,滴定后气泡消失,使测定结果_____________
③若刚见到指示剂局部的颜色有变化就停止滴定,使测定结果_____________
④读数时,若滴定前仰视,滴定后俯视,使测定结果_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】向硝酸酸化的2 mL 0.1 mol·L-1 AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈棕黄色,试管底部仍存在黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行了如下探究。
Ⅰ.探究Fe2+产生的原因。
(1)提出猜想:Fe2+可能是Fe与________或________反应的产物。(均填化学式)
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5 min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液。
液体试剂 | 加入铁氰化 | |
钾溶液 | ||
1号试管 | 2 mL 0.1 mol·L-1 | |
AgNO3溶液 | 无蓝色沉淀 | |
2号试管 | 硝酸酸化的2 mL 0.1 mol·L-1______溶液(pH=2) | 蓝色沉淀 |
①2号试管中所用的试剂为_________。
②资料显示:该温度下,0.1 mol·L-1 AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为_______。
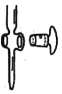
③小组同学继续进行实验,证明了由2号试管得出的结论正确。实验如下:取100 mL 0.1 mol·L-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉并搅拌,分别插入pH传感器和NO![]() 传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
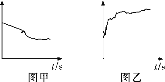
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为__________。
Ⅱ.探究Fe3+产生的原因。
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化了。小组同学设计了不同的实验方案对此进行验证。
(3)方案一:取出少量黑色固体,洗涤后,______(填操作和现象),证明黑色固体中有Ag。
(4)方案二:按下图连接装置,一段时间后取出左侧烧杯中的溶液,加入KSCN溶液,溶液变红。该实验现象________(填“能”或“不能”)证明Fe2+可被Ag+氧化,理由为________。
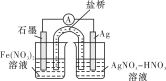
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+
O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+![]() O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+
O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+![]() O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为____离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____,钛极附近的pH值________(填“增大”“减小”或“不变”)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:![]() △H>0。水蒸气的浓度随时间t变化如下表所示:
△H>0。水蒸气的浓度随时间t变化如下表所示:
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | p>T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2_________T1(填“﹥”“﹤”或“﹦”),能否通过对比实验①③到达平衡所需时间长短判断:_________(填 “能”或“否”)。
②实验①前20 min的平均反应速率 v(O2)=_________
③催化剂的催化效率:实验①___________实验②(填“﹥”或“﹤”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
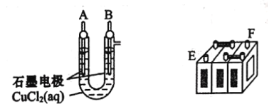
(1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
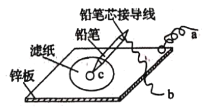
①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
(1)H2A为_____(填“强”或“弱”)酸,向H2A溶液中加水会使 的值_______ (填“增大”、“减小”或“不变”)。
的值_______ (填“增大”、“减小”或“不变”)。
(2)若M是由一种溶质组成的溶液,则
①M的溶质可以是Na2A或_________,Na2A的水溶液pH__________ (填“<”、“ >”或“=”)7
②向Na2A溶液中加人__________ (填字母)可抑制其水解。
A. 氯化铵固体 B. KOH 固体 C. 水 D. 升高温度
③已知Ksp(CuA)=1.3![]() 10-36,向20mL1 mo1·L-1Na2A溶液中加入10mL1 mo1·L-1CuCl2溶液,混合后溶液的Cu2+为____________mo1·L-1。(忽略A2-的水解)
10-36,向20mL1 mo1·L-1Na2A溶液中加入10mL1 mo1·L-1CuCl2溶液,混合后溶液的Cu2+为____________mo1·L-1。(忽略A2-的水解)
(3)若溶液M由10mL1.00 mo1·L-1H2A溶液与10mL1.00mo1·L-1NaOH溶液混合而成,下列关于溶液M的说法正确的是______(填字母)。
A.c(A2-)+ c(HA-)+ c(H2A)=1 mo1·L-1
B.若溶液显酸性,则c(Na+)>c(HA-)> c(H+)>c(A2-)>c(OH-)
C.离子浓度关系:c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D. 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1 mo1·L-1的Na2A、NaHA混合溶液中,![]() =______
=______
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种清洁、高效新能源, 也是重要的化工原料。
(1)通过热化学循环在较低温度下由硫化氢分解制备氢气的反应系统原理为:
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-151kJmol-1
2HI(aq)=H2(g)+I2(s) H2=+110kJmol-1
H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) H3=+61kJmol-1
(热化学硫碘循环硫化氢分解联产氢气、硫磺系统)
通过计算可知,该系统制氢的热化学方程式为___________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为CO(g)+2H2(g)CH3OH(g)ΔH= -116 kJ·mol-1。如图表示CO的平衡转化率(α)随温度和压强变化的示意图:
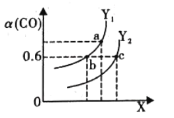
①X 表示的是______ (填“温度”或“压强”) ,理由是_________;Y1______Y2 (填“<”、“ >”或“=”)
②在2L恒容密闭容器中充入2 mol CO 和4 mol H2,一定条件下经过10 min 达到平衡状态c 点处。在该条件下,从开始至达到平衡状态v(CH3OH) =______ molL-1min -1,平衡常数K=________(填最简分数)。平衡常数Ka、Kb、Kc的大小关系是______
③下列措施既能增大反应速率又能提高反应物转化率的是______ (填字母)。
A. 使用催化剂 B. 及时分离CH3OH C.升高温度 D.增大压强
(3) 已知燃料电池的比能最与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由大到小的顺序为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法不正确的是( )
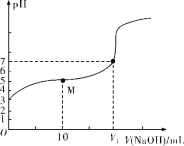
A.HX为弱酸
B.V1<20
C.M点溶液中离子浓度由大到小的顺序:c(X-)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 NaOH溶液和0.1 mol·L-1 HX溶液等体积混合后,溶液中c(Na+)=c(X-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】共用两个及两个以上碳原子的多环烃称为桥环烃,共用的碳原子称为桥头碳。桥环烃二环[2.2.0]己烷的碳原子编号为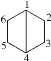 。下列关于该化合物的说法错误的是( )
。下列关于该化合物的说法错误的是( )
A.桥头碳为1号和4号
B.与环己烯互为同分异构体
C.二氯代物有6种(不考虑立体异构)
D.所有碳原子不可能位于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com