
科目: 来源: 题型:
【题目】(1)某含碳、氢、氧三种元素的未知物A,经燃烧分析知其碳的质量分数为60%,氧的质量分数为26.7%,则其实验式为 _______;
(2)物质A相对于相同状况下的氢气的密度是30,则A的分子式为________,可能的结构式有________种;
(3)A的红外光谱图上发现有O﹣H键、C﹣H键和C﹣O键的振动吸收,则A的结构简式可能为(有几种写几种)________ ;
(4)A的核磁共振氢谱有三个吸收峰,峰面积之比为1:1:6,则A的名称是 ________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10mol·L-1的AgNO3溶液分别滴定体积均为50.0mL的由Cl-与Br-组成的混合溶液和由C1-与I-组成的混合溶液(两混合溶液中Cl-浓度相同,Br-与I-的浓度也相同),其滴定曲线如图所示。已知25℃时:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=4.9×10-13,Ksp(AgI)=8.5×10-16。
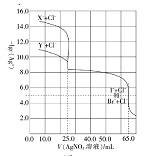
下列有关描述正确的是( )
A.图中X-为Br-
B.混合溶液中n(Cl-):n(I-)=8:5
C.滴定过程中首先沉淀的是AgCl
D.当滴入AgNO3溶液25mL时,Cl-与Br-组成的混合溶液中c(Ag+)=7×10-7mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】烷基取代苯![]() 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成![]() ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到![]() 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为![]() 的异构体共有7种,其中的3种是
的异构体共有7种,其中的3种是![]() 、
、![]() 、
、![]() 。请写出其他4种的结构简式:_________________、________________、_________________、___________________。
。请写出其他4种的结构简式:_________________、________________、_________________、___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机物的命名正确的是
A.  3﹣甲基﹣2﹣乙基戊烷
3﹣甲基﹣2﹣乙基戊烷
B. (CH3)3CCH2CH(C2H5)CH32,2﹣二甲基﹣4﹣乙基戊烷
C. ![]() 邻甲基苯酚
邻甲基苯酚
D. ![]() 2﹣甲基﹣3﹣戊炔
2﹣甲基﹣3﹣戊炔
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
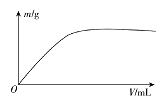
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯取代物的数目分别是( )
A.2个甲基,能生成4种一氯代物 B.4个甲基,能生成1种一氯代物
C.3个甲基,能生成5种一氯代物 D.4个甲基,能生成4种一氯代物
查看答案和解析>>
科目: 来源: 题型:
【题目】厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,腐蚀图解如图所示。下列说法正确的是( )
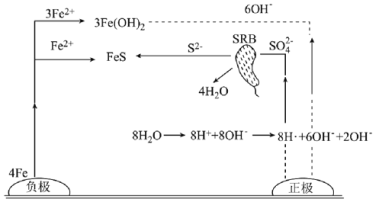
A.正极的电极反应式为8H++8e-=8H·(吸附)、SO42-+8H·(吸附)![]() S2-+4H2O
S2-+4H2O
B.正极区溶液的pH变小
C.生成1molFeS,转移6mol电子
D.若引入新细菌,一定会加速金属的腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() C和
C和![]() C是碳元素的2种核素,它们互为同位素
C是碳元素的2种核素,它们互为同位素
B. 化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与C60互称同素异形体
C.  与
与 互为同分异构体
互为同分异构体
D. 硝基苯可看成是由![]() 和—NO2两种基团组成
和—NO2两种基团组成
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,锂离子电池是目前应用广泛的一类电池。以钛铁矿(主要成分为FeTiO3,含有少量MgO、Fe2O3、SiO2等杂质)为原料,制备锂离子电池电极材料的工艺流程如图所示:
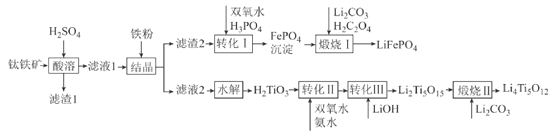
已知:①滤液1中含Ti微粒的主要存在形式为TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)滤渣1中主要成分的化学式为__。
(2)“结晶”温度需控制在70℃左右,若温度过高会导致的后果为__。
(3)“转化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,则溶液中c(PO43-)的范围为__。
(4)“煅烧I”反应中氧化剂和还原剂的物质的量之比为__。
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示。T0℃时,一定时间内H2TiO3的转化率最高的原因为__。
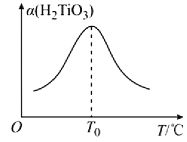
(6)Li2Ti5O15中-1价与-2价O原子的数目之比为___。“煅烧II”反应中同时生成两种参与大气循环的气体,该反应的化学方程式为__。
(7)某锂离子电池放电时的电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,则充电时阳极的电极反应式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com