
科目: 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4溶液为电解质溶液。下列有关说法不正确的是

A. a极为负极,电子由a极经外电路流向b极
B. a极的电极反应式:H2-2e-===2H+
C. 电池工作一段时间后,装置中c(H2SO4)增大
D. 若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。下列说法正确的是
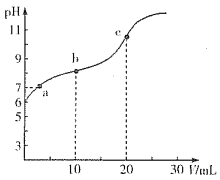
A. 常温下K(HX)≈1×10-12
B. a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+)
C. c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10mol·L-1
D. 相同条件下,X-的水解能力弱于HX的电离能力
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
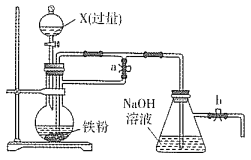
A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
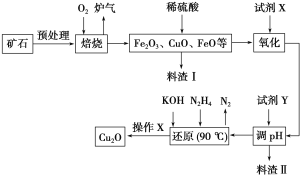
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H是重要的化学物质,在实验室中合成路线(部分反应条件及产物已略去)如图:
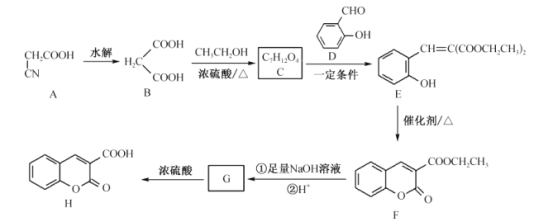
回答下列问题:
(1)E中含氧官能团的名称为__,D的化学名称是__。
(2)写出F与NaOH溶液反应的化学方程式:__。
(3)由B生成C的反应类型为__。
(4)E生成F过程中,另一产物的结构简式为__。
(5)K是D的同系物,且相对分子质量比D大14,K的同分异构体同时具有下列两个特征:
①含有苯环;②能发生水解反应和银镜反应。满足上述条件的K的同分异构体有__种(不含立异构),核磁共振氢谱有4组峰的结构简式为__。
(6)参照上述合成路线,写出以乙烯、乙醛和B为初始原料合成![]() 的路线__(其他无机试剂可任选)。
的路线__(其他无机试剂可任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钻蓝(含Co、Al、O三种元素)是一种带绿光的蓝色颜料。固相法是制备钴蓝颜料方法之一,即将钴、铝的氧化物(或是两者的氢氧化物)按一定比例负载于石墨烯上,然后在马弗炉中高温灼烧、冷却、研磨。回答下列问题:
(1)基态钴原子核外电子排布式为[Ar]__。
(2)下列O原子电子排布图表示的状态中,能量最低的是__(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)已知Co的活泼性与Fe相近,Co、Al、O的电负性从大到小的顺序为__。
(4)石墨烯的结构如图甲所示。
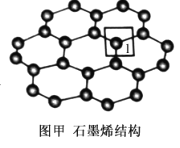
①每个石墨烯分子中,C(如图中1位置处)可形成σ键的个数为__,其杂化类型为___。
②C原子在形成化合物时,其键型以共价键为主,原因是__。
(5)钴蓝晶胞结构如图乙所示,其立方晶胞由4个I型和4个II型小立方体构成。

①钴蓝的化学式为__。
②已知NA为阿伏加德罗常数的值,钴蓝晶体的密度为__g·cm-3(列计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。回答下列问题:
(1)已知:I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) H=-238kJ·mol-1
II.2H2(g)+O2(g)=2H2O(g) H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)![]() C3H6(g)+H2(g)的H为__。
C3H6(g)+H2(g)的H为__。
(2)一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,发生丙烷脱氢制丙烯反应。
①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是__(填字母)。
A. 该反应的焓变(H)保持不变
B. 气体平均摩尔质量保持不变
C. 气体密度保持不变
D. C3H8分解速率与C3H6消耗速率相等
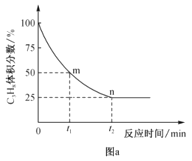
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图a所示。此温度下该反应的平衡常数Kp=__kPa(用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
③已知上述反应中,v正=k正·p(C3H8),v逆=k逆·p(C3H6)p(H2),其中k正、k逆为速率常数,只与温度有关,则图a中m点处![]() =_。
=_。
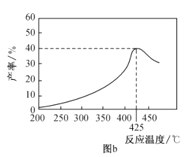
(3)保持相同反应时间,在不同温度下,丙烯产率如图b所示,丙烯产率在425℃之前随温度升高而增大的原因可能是__、__;425℃之后,丙烯产率快速降低的主要原因可能是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验室以铜屑(含有少量CuO)为原料制备适量无水Cu(NO3)2工艺流程如图:
![]()
已知:①SOCl2熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体;
②4NH3·H2O+Cu2+=[Cu(NH3)4]2++4H2O;
[Cu(NH3)4]2+对特定波长光的吸收程度(用吸光度A表示)与Cu2+在一定浓度范围内成正比。回答下列问题:
(1)从绿色化学、原子经济性角度考虑,试剂X为__。
(2)步骤II包括蒸发浓缩、冷却结晶等步骤,蒸发时所用容器名称是__,停止加热的时机是__。
(3)步骤III在如图1所示装置(夹持及控温装置省略)中进行。
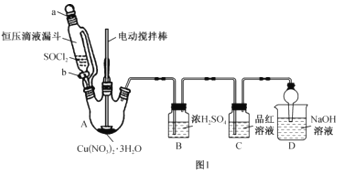
①实验中,若仅打开装置活塞b的情况下,恒压滴液漏斗中液体__(填“能”或“不能”)全部流下。
②C中产生的现象是__。
③D的作用是__。
④写出A中三颈烧瓶内Cu(NO3)2·3H2O与SOCl2恰好反应生成Cu(NO3)2的化学方程式:__。
(4)用分光光度法可测定产品的纯度。现准确称取0.50g无水Cu(NO3)2产品,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.600。已知[Cu(NH3)4]2+的吸光度A与Cu2+标准溶液浓度关系如图2所示。
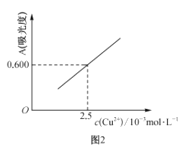
①量取10.00mLCu(NO3)2溶液所用量器名称是__。
②无水Cu(NO3)2的纯度是__(以质量分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】采用电化学法还原CO2是一种使CO2资源化的方法。下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。下列说法中正确的是

A. Zn与电源的负极相连
B. ZnC2O4在交换膜右侧生成
C. 电解的总反应为2CO2+Zn![]() ZnC2O4
ZnC2O4
D. 通入11.2 L CO2时,转移0.5 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com