
科目: 来源: 题型:
【题目】氯化亚铜(![]() )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含![]() 、
、![]() 、
、![]() 、
、![]() )生产
)生产![]() 的流程如图所示:
的流程如图所示:
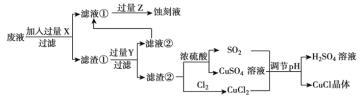
根据以上信息回答下列问题:
(1)生产过程中:X是________,Z是________。(均填化学式)
(2)写出生成![]() 的离子方程式________。
的离子方程式________。
(3)析出的![]() 晶体不用水而用无水乙醇洗涤的原因是________。
晶体不用水而用无水乙醇洗涤的原因是________。
(4)在![]() 的生成过程中理论上不需要补充SO2气体,其理由是________。
的生成过程中理论上不需要补充SO2气体,其理由是________。
(5)已知:常温下![]() ,
,![]() ,现向
,现向![]() 饱和溶液中加入
饱和溶液中加入![]() 固体至
固体至![]() ,此时溶液中
,此时溶液中![]() =________。
=________。
(6)实验探究pH对![]() 产率的影响如下表所示:
产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出![]() 晶体最佳pH为________,当pH较大时
晶体最佳pH为________,当pH较大时![]() 产率变低的原因是________。
产率变低的原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
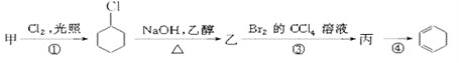
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知A的气态氢化物能与其最高价氧化物的水化物反应得到一种离子化合物,B的一种单质具有杀菌消毒的作用,C+和D3+的电子层结构相同,E的主族序数是其周期序数的2倍。
(1)F在元素周期表中的位置是__________________。
(2)上述元素形成的简单离子中,半径最大的是____________(填离子符号)。
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:

①若丙具有漂白性,则甲和水反应的离子方程式为__________________________。
②若乙的水溶液是强碱性溶液,物质丙为B的一种单质,则甲中含有的化学键的类型为________,D的单质与乙的水溶液反应的离子方程式为_________________。
③若甲为D和E形成的二元化合物,物质丙是气体,则丙的结构式为___________;物质乙为白色沉淀,其化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某药物分子结构简式如图所示,下列关于该物质的说法不正确的是( )
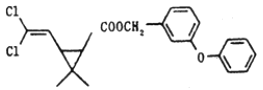
A.分子式为C21H20O3Cl2B.醚键上的氧原子至少与另外11个原子共面
C.该有机物最多与6molH2加成D.在一定条件下可发生加成、取代、氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
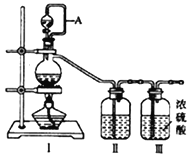
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
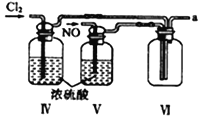
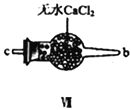
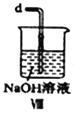
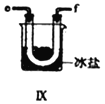
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
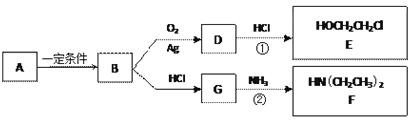
(1)B的结构简式是_________________
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3→ F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): ____________________________________
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:![]() )
)

(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是___________________________________
(6)丙中官能团的名称是_______________________________________。
(7)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是__________________________________________。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。
(1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。
(2)沉淀A的主要成分的化学式是___。
(3) “调pH”步骤中通入过量CO2,化学反应方程式___。
(4)酸溶时发生反应的离子方程式是___。
(5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 使
使![]() 和
和![]() 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和![]() ,当有
,当有![]() 参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
![]() 火箭和导弹表面的薄层是耐高温物质
火箭和导弹表面的薄层是耐高温物质![]() 将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料
将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料![]() ,则反应过程中,每转移1mol电子放出的热量为____________.
,则反应过程中,每转移1mol电子放出的热量为____________.
![]() 甲胺
甲胺![]() 是合成太阳能敏化剂的原料。工业合成甲胺原理:
是合成太阳能敏化剂的原料。工业合成甲胺原理:![]()
![]()
![]() 。
。
![]() 已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 |
|
|
|
|
|
键能 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的![]() ______________。
______________。
若![]() 的活化能为
的活化能为![]() ,由此计算
,由此计算![]()
![]() 的活化能
的活化能![]() ______。
______。
![]() 用
用![]() 将HCl转化为
将HCl转化为![]() ,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
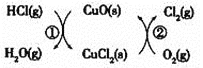
其中,反应![]() 为:
为:![]() 反应
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则总反应的热化学方程式为_____________,
,则总反应的热化学方程式为_____________,![]() 反应热用
反应热用![]() 和
和![]() 表示
表示![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com