
科目: 来源: 题型:
【题目】均为0.1 mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
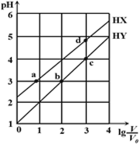
A.a、b两点的溶液中:c(X-)=c(Y-)
B.相同温度下,电离常数K(HX):d>a
C.溶液中水的的电离程度:d>c>b>a
D.lg![]() =2时,若同时微热两种液体(不考虑挥发),则
=2时,若同时微热两种液体(不考虑挥发),则![]() 减小
减小
查看答案和解析>>
科目: 来源: 题型:
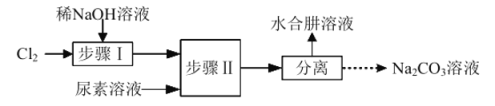
【题目】利用![]() 溶液、尿素
溶液、尿素![]() 为原料制取水合肼
为原料制取水合肼![]() 的流程如下:
的流程如下:
已知:①![]()
②![]() 沸点约
沸点约![]() ,具有强还原性,能与
,具有强还原性,能与![]() 剧烈反应生成
剧烈反应生成![]() 。
。
下列说法错误的是( )
A.步骤Ⅰ、Ⅱ反应过程中需控制好温度
B.所得副产物![]() 可用于工业上吸收
可用于工业上吸收![]() 尾气
尾气
C.步骤Ⅱ具体操作为将尿素溶液逐滴加入![]() 溶液中
溶液中
D.水合肼与![]() 反应的离子方程式为:
反应的离子方程式为:![]() ↑
↑
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g) △H<0的影响如图所示,下列说法正确的是
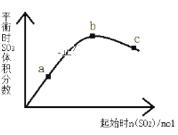
A.a、b、c三点中,平衡时的速率大小关系:v(b)>v(c)>v(a)
B.a、b、c三点中,a点时SO2的转化率最高
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.a、b、c三点的平衡常数Kb>Kc>Ka
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象、结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 上层液体呈橙红色 | 氧化性: |
B | 向 | 白色沉淀不溶解 |
|
C | 向盛有 | 溶液变蓝绿色,试管底有红色沉淀 | 氧化性: |
D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化的铝滴落 | 生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是原子序数依次增大的短周期主族元素,
是原子序数依次增大的短周期主族元素,![]() 在氧气中燃烧生成淡黄色固体。
在氧气中燃烧生成淡黄色固体。![]() 与其它四种元素不同周期,
与其它四种元素不同周期,![]() 相邻。
相邻。![]() 的最外层电子数是
的最外层电子数是![]() 次外层电子数的一半,两者形成的化合物结构如图所示。下列说法错误的是( )
次外层电子数的一半,两者形成的化合物结构如图所示。下列说法错误的是( )
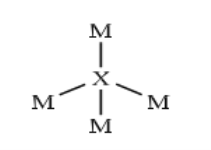
A.气态氢化物稳定性:![]()
B.简单离子半径:![]()
C.![]() 的氧化物可能均具有漂白性
的氧化物可能均具有漂白性
D.Y分别与![]() 形成的二元化合物均含离子键
形成的二元化合物均含离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁![]() 的结构简式为
的结构简式为![]() ,与芳香族化合物性质相似,广泛应用于航天、化工等领域,可以环戊二烯与铁为原料制得。下列说法错误的是( )
,与芳香族化合物性质相似,广泛应用于航天、化工等领域,可以环戊二烯与铁为原料制得。下列说法错误的是( )
A.环戊二烯的化学式为![]() B.二茂铁的一氯取代物有2种
B.二茂铁的一氯取代物有2种
C.二茂铁能发生加成反应、氧化反应D.二茂铁中的铁为![]() 价
价
查看答案和解析>>
科目: 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O ![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.①④B.③④C.②⑤D.②③
查看答案和解析>>
科目: 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目: 来源: 题型:
【题目】以低品位红土镍矿(主要成分可表示为![]() 、
、![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 、
、![]() )为原料制备纳米级
)为原料制备纳米级![]() 的工艺流程如下:
的工艺流程如下:

已知氢氧化物的参数如下表:
氢氧化物 | 溶度积 | 开始沉淀 | 完全沉淀 |
|
| 4.1 | 5.5 |
|
| 2.2 | 3.5 |
|
| 6.7 | 9.5 |
|
| 9.4 | 12.4 |
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是______(填化学式)。
(2)常温下,调![]() 的目的是______。当
的目的是______。当![]() 时,溶液中
时,溶液中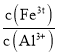 =______
=______
(3)写出“除铜镍”过程发生反应的离子方程式为![]() 、______________。“除钙”过程反应温度不宜超过
、______________。“除钙”过程反应温度不宜超过![]() 的原因_________________________。
的原因_________________________。
(4)“滤液”中溶质的主要成分为________________,获取该物质晶体的具体实验操作为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com