
科目: 来源: 题型:
【题目】硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。某研究小组设计制备SnSO4与SnCl4路线如下。完成下列填空:
(一)制备SnSO4
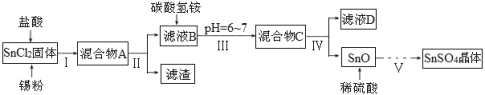
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
(1)SnCl2用盐酸进行酸溶的原因是_____________________。
(2)步骤Ⅱ中用到的玻璃仪器除烧杯外还有____________;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为______________。
(3)步骤Ⅴ依次操作:蒸发浓缩、_________、_________、洗涤、低温干燥,即可得到产物。
(二)制备SnCl4
实验室用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。实验装置如图所示:
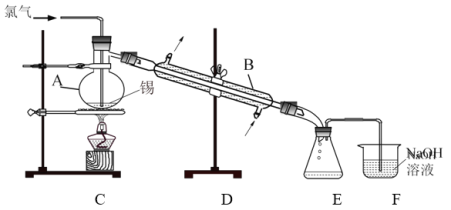
(4)仪器B的名称______________。
(5)图中尾气处理装置不够完善,改进的方法是:________________(可以画图,也可以用文字表述,需注明仪器、试剂及连接位置等)。
(6)若反应中用去锡粉11.9 g,反应后在锥形瓶中收集到23.8 g SnCl4,则SnCl4的产率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】制烧碱所用盐水需两次精制。
第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(1)过程Ⅰ除去的离子是_______________。
(2)检测Fe3+是否除尽的方法是____________________。
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因______________。
(4)除去Mg2+的离子方程式是________________。
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____________。
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:
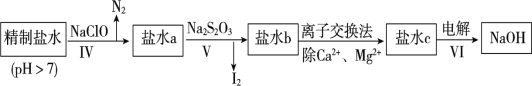
(6)过程Ⅳ除去的离子是__________________。
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高温、催化剂条件下,某反应达到平衡,平衡常数K=![]() 恒容时,温度升高,H2浓度减小.下列说法正确的是( )
恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A. 该反应的焓变为负值
B. 2CO2(g)+2H2(g)2CO(g)+2H2O(g) 的平衡常数K1=K2
C. 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
D. 若恒容、恒温下充入CO,则K值变大
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)该反应平衡常数的表达式K=______________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a. 平衡常数K增大 b. H2O的浓度减小
c. 容器内的压强增大 d. v逆(O2)减小
(3)部分实验数据见下表(条件:2 L容器、催化剂、光、N21 mol、水3 mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是______________。第四组容器内NH3生成量最小的可能原因是__________________。
(4)若用该反应进行工业生产,请选择适宜的条件________________。(答两条)
(5)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则工业合成氨的热化学方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),则断开1 mol N-H键所需的能量是_______kJ。
2H(g),则断开1 mol N-H键所需的能量是_______kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
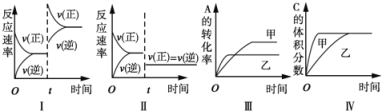
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目: 来源: 题型:
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。完成下列填空:
(1)写出一个包含上述七种物质的氧化还原反应方程式,配平并标出电子转移方向和数目:___________________________。
(2)上述反应中,氧化剂是_____________,每转移1 mol电子,生成Cl2_____ L(标准状况)。
(3)在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子反应方程式:_________________。
(4)根据以上实验,写出两个反应中氧化剂、氧化产物的氧化性强弱顺序__________。
(5)上述氧化还原反应体系中,属于第三周期元素的简单离子半径由大到小的顺序为________
(6)氯原子的最外层电子的轨道式为___________,氯原子核外有_______不同运动状态的电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,电火花点燃,反应结束,容器内的压强为零(温度150℃),将残留物溶于水,无气体产生,下列叙述正确的是
A.原混合气体中O2和CH4的体积比为2:1
B.残留物中只有Na2CO3
C.原混合气体中O2和CH4的物质的量之比为1:2
D.残留物只有Na2CO3和NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释实验现象的方程式错误的是
A.向苯酚溶液中逐滴加入浓溴水,生成白色沉淀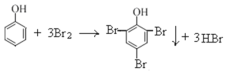
B.向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2 + 2Fe3+ → 2Fe(OH)3↓+ 3Mg2+
C.向水杨酸( ![]() )中滴加NaHCO3溶液,放出无色气体:
)中滴加NaHCO3溶液,放出无色气体:![]() + 2HCO3- →
+ 2HCO3- →![]() + 2CO2↑ + 2H2O
+ 2CO2↑ + 2H2O
D.向Ba(OH)2中加入H2SO4至中性:Ba2++OH-+SO42-+H+ →BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
A. 当HI、H2、I2浓度之比为2∶1∶1时,说明该反应达平衡
B. c(HI)由0.07 mol/L降到0.05 mol/L所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001 mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H >0
Z(g)+W(s);△H >0
下列叙述正确的是
A. 减少少量W,逆反应速率减小
B. 当容器中气体的平均摩尔质量不变时,反应达到平衡
C. 降低温度,平衡正向移动
D. 平衡后加入Z,上述反应的△H减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com