
科目: 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3。据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) + 6H2(g)-Q
2Fe(s) + 3CO(g) + 6H2(g)-Q
(1)原子序数为26的铁元素位于元素周期表的第________周期__________族。
(2)反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g。则该段时间内H2的平均反应速率为____________________。
(3)将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是__________________。
A、CH4的转化率等于CO的产率
B、混合气体的平均相对分子质量不变
C、v正(CO):v逆(H2)=1︰2
D、固体的总质量不变
(4)FeO可用CO进行还原,已知:t℃时, FeO(s) +CO(g) ![]() Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
(5)Fe2O3还可用来制备FeCl3 ,FeCl3在水溶液中的水解分三步:
Fe3+ + H2O![]() Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O![]() Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2
Fe(OH)2+ + H2O![]() Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是____________________。
(6)通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O![]() Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
A、加水稀释 B、加入少量NaCl固体
C、升温 D、加入少量Na2CO3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
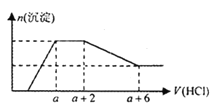
A.原溶液中一定含有Na2SO4
B.反应最后形成的溶液中的溶质只有NaCl
C.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答以下问题
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=________。
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=________。
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10—5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①下列说法正确的是__________
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1molL-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1molL-1 HClO溶液和0.1molL-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO、CO32-、ClO-结合H+的能力由强到弱的顺序为___
③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:![]() =________
=________
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应10min后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式______。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在含有AlO2—溶液中通入足量CO2 ,写出反应的离子方程式____________
(2)Al2O3在碳的还原作用下生成铝的气态低价氧化物X (X中Al与O的质量比为6.75∶2)则X的化学式为_________。
(3)三氟化氮(NF3)是一种无色、无臭的气体。三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,反应产物中生成酸M、酸N和一种无色气体(遇空气变成红棕色),其中酸M是一种弱酸,酸N为常见的含氧强酸。
① 写出该反应的化学方程式_________。
② 酸M是弱酸(难电离)的原因是____________
③一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO3、NaF等盐外,还可以生成的盐是____________(填化学式)。
④在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。写出a电极的电极反应式________。
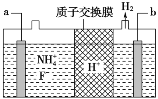
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A. 前2 min,D的平均反应速率为0.2 mol·L-1·min-1 B. 此时,B的平衡转化率是40%
C. 升高该体系的温度,化学平衡常数不变 D. 增加C,逆向速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A.氢氧化铝的酸式电离:Al(OH)3+H2O[Al(OH)4] —+H+
B.铜与稀硝酸的反应:Cu+4H++NO3—= Cu2+ + NO2+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2—的存在:2NO2—+2I—+4H+=2NO↑+I2+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.1 mol·L-1氯化铁溶液中阳离子数目大于NA
B.25℃与60℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( NaOH)相等
D.2SO2(g)+O2(g) = 2SO3 (g)和4SO2(g)+2O2(g) = 4SO3 (g)的H相等
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,反应3X(g)![]() 2Y(g)+Z(g)+W(s),ΔH=-QkJ·mol-1,反应已达到平衡的标志是
2Y(g)+Z(g)+W(s),ΔH=-QkJ·mol-1,反应已达到平衡的标志是
A. 混合气体的压强不再变化 B. 混合气体的密度不再改变
C. 反应混合物中各组分的浓度相等 D. 两种物质X、Y的反应速率之比为3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年,我国科学家屠呦呦因在青蒿素发现和治疗中的贡献,获得了诺贝尔生理学或医学奖。由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:
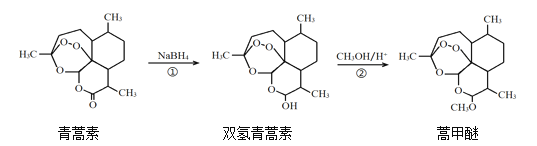
下列说法正确的是( )
A.青蒿素的分子式是C15H21O4
B.青蒿素在NaOH溶液中可以发生水解反应
C.反应②有H2O生成
D.反应①氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如下所示,由图可得出的正确结论是
SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如下所示,由图可得出的正确结论是
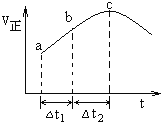
A. 反应在c点达到平衡状态
B. △t1=△t2时,SO2的转化率:a~b段小于b~c段
C. 反应物浓度:a点小于b点
D. 反应物的总能量低于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com