
科目: 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景. PPG的一种合成路线如下:
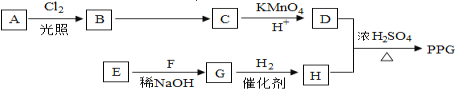
已知:
①烃A的相对分子质量为70,其一氯代物只有一种。
②化合物B为一氯代烃,化合物C的分子式为C5H8。
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质。
④R1CHO+R2CH2CHO
⑤R1CH2=CH2R2 →R1COOH+R2COOH
回答下列问题:
(1)A的结构简式为________________________________。
(2)B到C的反应条件________________________________。
(3)由E和F生成G的化学方程式为________________________,反应类型_________。
(4)由D和H生成PPG的化学方程式为___________________。
(5)写出D的最简同系物和H按1:1反应的产物______________________。
(6)写出G和新制的氢氧化铜溶液反应的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】莫沙朵林F是一种镇痛药,可通过木聚糖A按以下路线合成:

(1)有机物B中官能团的名称为____________________。有机物C中的碳碳双键如何检验____________________。
(2)写出同时满足下列条件的E的一种同分异构体的结构简式__________________________。
Ⅰ.存在四种不同化学环境的氢原子;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应。
(3)已知E+X→F为加成反应,写出该反应的化学方程式______________________________。
(4)已知:![]()
![]()
![]() 。化合物
。化合物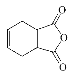 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以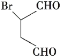 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。_____________
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。_____________
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A. 充电过程是化学能转化为电能的过程
B. 充电时阳极反应为Cd(OH)2+2e—="=" Cd + 2OH-
C. 放电时电池内部OH - 向正极移动
D. 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 冰镇的啤酒打开后泛起泡沫
B. 对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的单质及其化合物在生活和生产中有很重要的用途。
(1)氨是合成硝酸、铵盐和氮肥的基本原料。在一定条件下用氮气和氢气合成氨气,然后再用氨氧化法制取硝酸。在整个生产过程中,氮气的利用率为85%。写出氨氧化法制取硝酸的反应式____________现有0.2t液态氮,能生产出浓度为40%的硝酸______________千克。
(2)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2 g。
①Cu与Cu2O的物质的量之比?____________
②硝酸的物质的量浓度?___________
(3)将30mLNO和O2混合气体通入过量NaOH溶液中,充分反应后,溶液中只含两种溶质(不考虑水解),且剩余气体体积为2mL。求原混合气体中NO和O2体积比?______________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是

A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和______________。(填序号)
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是__________;不宜用盐酸的原因是____________。反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤。该步骤能够得到高锰酸钾的原理是____________。
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
(4)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知涉及到的反应:
Na2C2O4+H2SO4=H2C2O4(草酸)+Na2SO4 ,
5H2C2O4+ 2MnO4—+6H+=2Mn2++10CO2↑+ 8H2O
Na2C2O4的式量:134 KMnO4的式量:158)
Ⅰ.称取0.80 g 的高锰酸钾产品,配成50mL溶液。
Ⅱ.称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ.将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL。
a.判断达到滴定终点的标志是____________________________。
b.样品中高锰酸钾的质量分数为______________(保留3位小数)。
c.加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度__________。(填“偏高”、“偏低”或“无影响”)
d.将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,其原因可能为_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】硫的化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。完成下列填空:
(1)SO2具有还原性,可以和许多氧化剂反应。SO2气体通入硫酸酸化的K2Cr2O7溶液中恰好生成铬钾矾[KCr(SO4)2·12H2O]。写出该反应的化学方程式_____________,反应中被还原的元素是__________。
(2)过量的SO2通入Na2S溶液,写出有关的离子方程式____________。
(3)在1L 0.3mol/L的NaOH溶液中,通入4.48LSO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),请再写出两个等量关系:_______
(4)在室温下,下列曲线可以描述乙酸(甲、Ki=1.8×10﹣5)和次氯酸(乙、Ki=2.95×10﹣8)在水中的电离度与浓度关系的是_________。
A.
B.
C.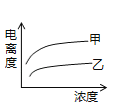
D.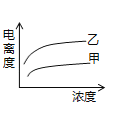
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com