
科目: 来源: 题型:
【题目】有一Na2SO3固体因部分被氧化而变质。为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
(甲同学)称取m g样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1 g。
(1)BaCl2溶液必须过量的原因是___________________________________________。在滤液中滴加____________溶液,若没有白色沉淀生成,则证明BaCl2溶液不足,还需继续在滤液中加入BaCl2溶液后进行过滤。洗涤残留固体的方法是__________________________________________________;在洗出液中滴加_______________溶液,可以判断残留固体是否洗涤干净。
(2)判断残留固体质量m1 g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是_________________________________________________________。
(乙同学)称取m g样品溶于水,配成溶液,用滴定管取V mL于锥形瓶中,用浓度为c mol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO32- + MnO4- SO42- + Mn2+ (未配平)
(3)配制样品溶液时,不一定需要的实验仪器是__________(选填答案编号)。
a.容量瓶 b.玻璃棒 c.滴定管 d.烧杯
(4)滴定终点的判断依据是___________________________________________________。
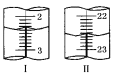
(5)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用__________________________________________。滴定管液面变化如图所示,从图Ⅰ图Ⅱ显示消耗的高锰酸钾溶液体积为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。
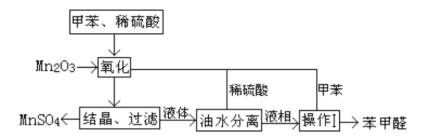
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)抽烟对人体有害,烟草不完全燃烧产生的CO被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生反应:CO+HbO2![]() O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
①上述反应的平衡常数表达式为K=_____________________。
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。已知37℃时,平衡常数K=220,这时HbCO的浓度__________HbO2浓度的0.02倍(填“大于”“等于”、或“小于”)。
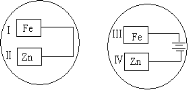
(2)把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是________和__________。(填序号“I”“II”“III”或“IV”)
(3)一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
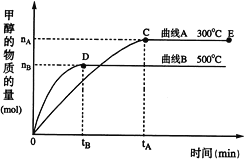
根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=___________,升高温度,K值 ________________。(填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=___________________。
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的![]() ,下列有关该体系的说法正确的是__________
,下列有关该体系的说法正确的是__________
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时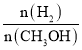 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下列材料,完成相应填空
某同学设计了如下装置用于制取SO2和验证SO2的性质。已知:1.0mol/L的Fe(NO3)3溶液的![]() 。试回答以下问题:
。试回答以下问题:
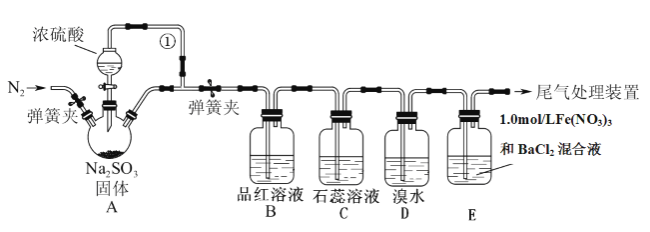
(1)装置A中用于添加浓硫酸的仪器名称为________________________,导管①的作用是______________________。
(2)B、C、D三个装置分别先后验证了SO2的哪些性质_______。
A.吸附性、酸性、还原性 B.还原性、酸性、还原性
C.漂白性、酸性、还原性 D.漂白性、酸性、氧化性
(3)SO2和品红反应的原理是_______________________________。
(4)实验前鼓入N2的目的是____________________________,简述此操作是否有必要_______________________________
(5)装置E中产生了白色沉淀,其成分是______________(填名称),分析E中产生白色沉淀的可能原因及观察到的现象。(写两种)可能①:_____________________;现象:___________。可能②:_____________________;现象:___________。
(6)若用2.0mol/L 的NaOH溶液吸收SO2尾气,请画出该尾气吸收装置_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
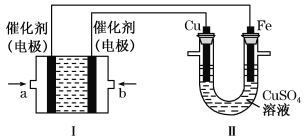
①a处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是______________;
②电镀结束后,装置Ⅰ中溶液的pH _________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度____________________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________________ ;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化6.4 g,则装置Ⅰ中理论上消耗甲烷__________L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】液氯储罐中常混有NCl3,当液氯中NCl3的质量分数达到4%以上就有爆炸危险。
(1)NCl3易水解生成一种碱性气体和一种具有漂白性的物质。写出该反应的化学方程式________________________________________________。
(2)为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为:NCl3+4HCl→NH4Cl+3Cl2),再用400 mL 20.0%(ρ=1.22g/cm3)的工业NaOH溶液吸收所有的Cl2,测得吸收后NaOH溶液增重51.4 g。经测定NCl3吸收管内NH4+质量为0.270 g。
①上述工业NaOH溶液的物质的量浓度为____________。
②计算该样品中NCl3的质量分数,并判断该样品是否安全?(写出计算过程)____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温时,将2 mol A和2 mol B气体投入固定容积为2 L的密闭容器中发生反应:2A(g)+B(g)![]() xC(g)+D(s),10 s时,测得A的物质的量为1.7 mol,0~10 s内C的反应速率为0.0225 mol·L-1·s-1;40 s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10 s时,测得A的物质的量为1.7 mol,0~10 s内C的反应速率为0.0225 mol·L-1·s-1;40 s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=________;
(2)平衡时容器中B的体积分数为________;
(3)该温度下此反应的平衡常数表达式为_____________,数值是__________;
(4)下列各项能表示该反应达到平衡状态的是________________________;
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】有人设想合成具有以下结构的烃分子。
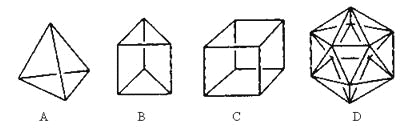
(1)结构D显然是不可能合成的,原因是________________________________;
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写出金刚烷的分子式___________;
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是______
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)下列有关烃的说法正确的是_______
a.不符合通式CnH2n+2的烃都一定含不饱和键;
b.烃分子中H原子个数不一定都比C原子个数多;
c.若知道了某烃的C、H原子个数比,只能得出该烃的最简式,不可能得出分子式;
d.烃分子中H%最高的是甲烷。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2S溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Na2S2,其溶液显黄色并有强碱性。
(1)写出该反应的化学方程式:___________________________________。并写出Na2S2的电子式___________该物质中所具有的化学键的类型_______________;该反应中的Na2S表现了_____________性,当生成1mol Na2S2时,转移电子数目为___________。
(2)在碱性溶液中,多硫化钠Na2Sx(x≥2),可被NaClO氧化为硫酸钠,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则X的值为________。
A.5 B.4 C.3 D.2
(3)常温下Na2S溶液显______(填酸性、中性或碱性),理由是(用离子方程式表示)__________________________。
(4)常温pH=10的0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应。有关物质的量随时间的变化如图所示。
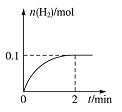
(1)0~2 min内的平均反应速率![]() _____
_____![]() 平衡常数表达式为
平衡常数表达式为![]() _________________。
_________________。
(2)相同温度下,若开始加入![]() 的物质的量是原来的2倍,则____是原来的2倍。
的物质的量是原来的2倍,则____是原来的2倍。
A.平衡常数 B.![]() 的平衡浓度
的平衡浓度
C.达到平衡的时间 D.平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的_____。
A.充入少量氨气 B.降温至0℃ C.充入少量硫化氢 D.加压
(4)常温下,将![]() 的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
① 浓度为![]() 的氨水b L;②
的氨水b L;② ![]() 的氨水c L;③
的氨水c L;③ ![]() 的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:_________________。
的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:_________________。
(5)常温下,取![]() 的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是___(填“A”或“B”);设盐酸中加入的Zn质量为
的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是___(填“A”或“B”);设盐酸中加入的Zn质量为![]() ,醋酸溶液中加入的Zn质量为
,醋酸溶液中加入的Zn质量为![]() ,则
,则![]() ___
___![]() 。(选填“<”、“=”、“>”)
。(选填“<”、“=”、“>”)
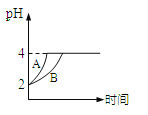
(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是____。

A.在A、B间任一点,溶液中一定都有![]()
B.在B点,![]() ,且有
,且有![]()
C.在C点:![]()
D.在D点:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com