
科目: 来源: 题型:
【题目】已知A是由两种阳离子和一种阴离子组成的盐,且常用作净水剂,B是一种常见的两性氢氧化物。试根据下列转化关系回答有关问题:

(1)试判断:B为___,F为___;
(2)写出沉淀B与盐酸反应的离子方程式___;
(3)根据上述关系写出盐A的化学式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究,其反应原为:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe3O4+8HCl(浓)
Fe3O4+4H2,Fe3O4+8HCl(浓)![]() FeCl2+2FeCl3+4H2O。
FeCl2+2FeCl3+4H2O。
根据如图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。

试回答下列问题:
(1)实验中使用肥皂液检验的产物是___;图中湿棉花的作用是___;
(2)甲组同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
实验序号 | 实验操作 | 实验现象 |
① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中滴加几滴KSCN溶液,充分振荡 | 溶液没有出现血红色 |
根据上述实验,他们不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是___;
(3)乙组同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
实验序号 | 实验操作 | 实验现象 |
① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
请根据乙组同学的实验操作和现象,你认为残留黑色固体中一定___(填“存在”或“不存在”)Fe3O4。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。

请按要求回答下列问题:
(1) 写出②的元素名称__________;
(2) 将④、⑤和⑥三种元素相比较,金属性最强的是__________(填元素符号);
(3) 元素③的最高价氧化物对应的水化物的化学式为____________________;
(4) 元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
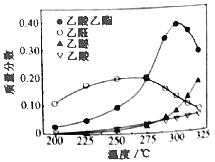
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
科目: 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是( )
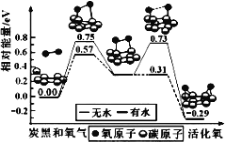
A.氧分子的活化是 O-O 的断裂与 C-O 键的生成过程
B.炭黑颗粒是大气中 SO2 转化为 SO3 的催化剂
C.每活化一个氧分子吸收 0.29eV 能量
D.水可使氧分子活化反应的活化能降低 0.42eV
查看答案和解析>>
科目: 来源: 题型:
【题目】苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
⑴把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在_______层(填“上”或“下”);
⑵把苯加入到盛有少量高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中________(填“有”或“没有”)碳碳双键;
⑶在浓硫酸作用下,苯在50~60℃可以与浓硝酸反应生成硝基苯,反应的化学方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. SO3+H2O=H2SO4 B. CaCO3![]() CaO+CO2↑
CaO+CO2↑
C. Zn+H2SO4=ZnSO4+H2↑ D. AgNO3+HCl=AgCl↓+HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸式滴定管准确移取 25.00mL 某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.2000molL﹣1 的氢氧化钠溶液滴定(指示剂为酚酞),滴定结果如下:
NaOH 起始读数 | NaOH 终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.30mL |
第三次 | 0.50mL | 16.30mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为________molL﹣1。
(2)酸式滴定管使用的第一步操作是________
(3)以下操作造成测定结果偏高的原因可能是________。
A.振荡锥形瓶时有液滴溅出
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气里含有 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g) ΔH>0,已知该反应在 240℃时,平衡常数 K=64×10-4。请回答:
(1)该温度下,向 2 L 的密闭容器中充入 N2 和 O2 各 1 mol,5分钟后O2的物质的量为 0.5 mol,则 用N2表示的反应速率为________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ (填字母序号)。
A.消耗 1 mol N2 同时生成 1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将 N2、O2 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
A.  B.
B. 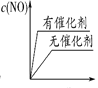 C.
C. 
(4)该温度下,某时刻测得容器内 N2 、O2、NO 的浓度分别为 2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和 3.0×10-3mol·L-1,此时反应________ (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com