
科目: 来源: 题型:
【题目】已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO;HClO
HCl+HClO;HClO![]() H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2B.NaHCO3C.HClD.NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C.CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知咖啡酸的结构如图所示:
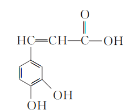
(1)咖啡酸属于__(填“无机化合物”或“有机化合物”)。
(2)咖啡酸中含氧官能团有羟基和__(填名称)。
(3)向咖啡酸溶液中滴加NaHCO3溶液,实验现象为__。
(4)咖啡酸溶液能使酸性高锰酸钾溶液褪色,说明咖啡酸具有__性。
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
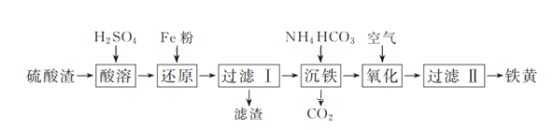
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
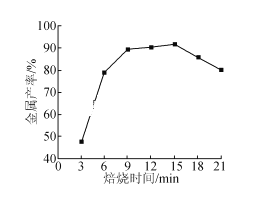
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:
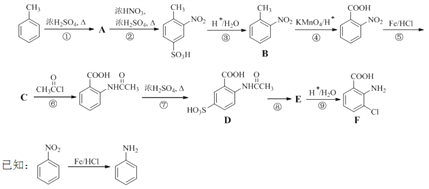
回答下列问题:
(1)![]() 分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
(2)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是______________。
(4)写出⑥的化学反应方程式:_________,该步反应的主要目的是____________。
(5)写出⑧的反应试剂和条件:_______________;F中含氧官能团的名称为__________。
(6)在方框中写出以 为主要原料,经最少步骤制备含肽键聚合物的流程。__________
为主要原料,经最少步骤制备含肽键聚合物的流程。__________
 ……
……![]() 目标化合物
目标化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH2=CH2+HBr![]() CH3CH2Br
CH3CH2Br
B.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
硫酸的工业用途非常广泛,可用于制造化肥、除铁锈、作电解液等。工业制硫酸的关键一步是将SO2氧化为SO3,该反应为2SO2+O2![]() 2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
【1】SO2与O2在一定条件下反应生成SO3,该反应属于( )
A.化合反应B.分解反应C.置换反应D.复分解反应
【2】上述材料中的反应是氧化还原反应,下列有关该反应的说法正确的是( )
A.O2是还原剂B.SO2被氧化
C.O2失去电子D.SO2发生还原反应
【3】上述材料中的反应在密闭容器中进行,下列关于该反应的说法正确的是( )
A.升高温度能减慢反应速率
B.SO2与O2能100%转化为SO3
C.减小O2的浓度能加快反应速率
D.使用恰当的催化剂能加快反应速率
【4】上述材料中的反应为放热反应,下列说法正确的是( )
A.断开化学键放出能量
B.放热反应都不需要加热
C.该反应的逆反应是吸热反应
D.该反应的反应物总能量小于生成物的总能量
查看答案和解析>>
科目: 来源: 题型:
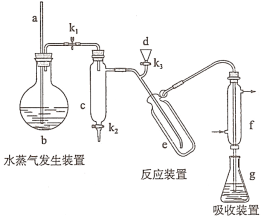
【题目】凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH3+H3BO3=NH3·H3BO3;
NH3·H3BO3+HCl= NH4Cl+ H3BO3。
回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水,打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si
B.共价键的极性:HF>HCl>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI
D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(2)FeCl3 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 FeCl3 的结构式为_________,其中 Fe 的配位数为___________________
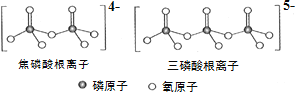
(3)NH4H2PO4 中,电负性最高的元素是________;P的________________杂化轨道与 O的2p轨道形成______键。NH4H2PO4 和 LiFePO4 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐, 如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示。这类磷酸根离子的化学式可用通式表示为 ______________(用 n 代表 P 原子数)。
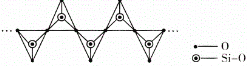
(4)高温高压下 CO2 的晶体结构与SiO2 相似,该晶体熔点比 SiO2 晶体____________(填“高”或“低”)。硅酸盐和 SiO2 一样,都是以硅氧四面体作为基本结构单元,图中表示一种含 n 个硅原子的单链式多硅酸根的结构(投影如图),Si 原子的杂化类型为_______________,其化学通式可表示为____________________
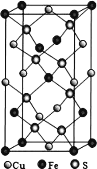
(5)四方晶系 CuFeS2 晶胞结构如图所示(下一页)。Cu2+的配位数为_______________,S2-的配位数为__已知:a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是_________________ gcm-3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如图:
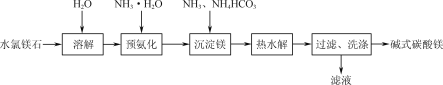
(1)为提高溶解速率,可以采取的措施有__(写一条)。
(2)检验碱式碳酸镁是否洗净的操作为___。
(3)预氨化过程中有Mg(OH)2沉淀生成,该过程发生反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com