
科目: 来源: 题型:
【题目】25℃时,向25ml氢氧化钠标准溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH变化曲线如下图所示:
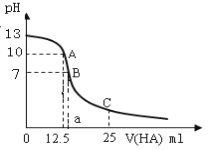
(1)该氢氧化钠溶液的物质的量浓度为__________mol·L1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH)= _______mol·L1。
(3)HA是____酸(选填“强”、“弱”)。
(4) 在B点所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的顺序是_____________。
(5)在C点所得混合溶液中,下列说正确的是________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有KOH标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)B→__→__→__→__→F。
(2)上述(B)操作的目的是___。
(3)判断滴定到达终点的现象是___。
(4)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为__mL,终点读数为___mL;所测盐酸溶液的浓度为___mol/L。

(5)若滴定终点读数时,俯视滴定管的刻度,其他操作均正确,则对滴定结果产生的影响是__。若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___。(填“偏高”、“偏低”、或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C变化如图所示。
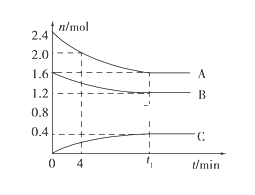
(1)写出该反应的化学方程式:___________;
(2)该温度下该反应的平衡常数为(保留两位有效数字)_______;
(3)已知:K(300℃)>K(350℃),该反应是________热反应;
(4)0~4分钟时,A的平均反应速率为____________;
(5)到达平衡时B的转化率为____________;
(6)恒容条件下,下列措施中能使![]() 降低的有__________。
降低的有__________。
A 充入氦气 B 使用催化剂
C 再充入2.4mol A和1.6mol B D 降低温度
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为纳米二氧化锰燃料电池,其电解质溶液呈酸性,已知(CH2O)n中碳的化合价为0价,有关该电池的说法正确的是

A. 放电过程中左侧溶液的pH降低
B. 当产生22gCO2时,理论上迁移质子的物质的量为4mol
C. 产生22gCO2时,膜左侧溶液的质量变化为:89g
D. 电子在外电路中流动方向为从a到b
查看答案和解析>>
科目: 来源: 题型:
【题目】MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2)制取MgSO4·7H2O的实验流程如下:
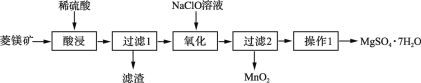
(1)过滤1的滤渣主要成分是____。
(2)氧化时发生反应的离子反应方程式为________________。
(3)操作1要经过____、____、过滤、洗涤、干燥等步骤才可得到产品。
(4)某MgSO4·7H2O产品中混有少量CaSO4、Al2(SO4)3、Fe2(SO4)3,可通过下列方法测定其纯度:
Ⅰ.称取待测样品10.00 g,加水溶解配成 250 mL溶液A待用。
Ⅱ.取10 .00 mL溶液A,加入三乙醇胺溶液,加入少许氨水调节pH至7~8,再用0.02 mol·L-1 EDTA(H2Y2-)与之充分反应,共用去EDTA溶液84.00 mL。
Ⅲ.取25.00 mL溶液A,加入三乙醇胺溶液,再加入0.125 mol·L-1 NaOH溶液调节pH至12~13,用0.02 mol·L-1 EDTA与之充分反应,共用去EDTA溶液10.00 mL。
已知:
① Mg2+在pH=9.1时开始沉淀,pH=12.1时沉淀完全;Ca2+在pH=13.1时还未沉淀。
② Mg2++H2Y2-=MgH2Y、Ca2++H2Y2-=CaH2Y。
③ 在三乙醇胺的作用下其他杂质不与EDTA反应。
计算样品中MgSO4·7H2O的质量分数__________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。
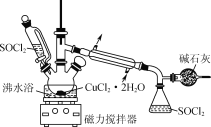
已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈反应生成两种酸性气体。
回答下列问题:
(1)CuCl2·2H2O晶体和SOCl2发生反应的化学方程式是___。
(2)碱石灰除了能吸收SO2、HCl等酸性气体,还能起到的作用为__。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,操作步骤如下:
步骤1:取0.2500g试样溶于水,加入过量KI固体充分反应,生成白色CuI沉淀。
步骤2:滴入几滴淀粉溶液。
步骤3:再滴入0.1000mol·L-1Na2S2O3溶液,发生的反应为2S2O32-+I2=S4O62-+2I-,恰好完全反应时,消耗Na2S2O3溶液18.00mL。
①恰好完全反应时的实验现象为__。
②计算试样中铜元素的质量分数__(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A.0.1mol/L CH3COOH溶液的pH>1:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) ![]() N2O4(g) △H<0
N2O4(g) △H<0
C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:![]() +H2O
+H2O![]()
![]() +OH-
+OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 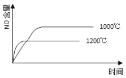
B. 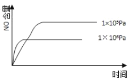
C. 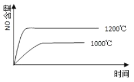
D. 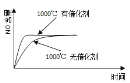
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com