
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.铝的第一电离能比镁的第一电离能大
B.同一主族元素从上到下电负性逐渐变大
C.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.最外层电子数是核外电子总数![]() 的原子和最外层电子排布式为4s24p5的原子是同种元素原子
的原子和最外层电子排布式为4s24p5的原子是同种元素原子
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.18g重水(D2O)所含电子的数目为10NA
B.6.4gS2、S4、S6的混合物中所含硫原子的数目为0.2NA
C.标准状况下,2.24LHF中分子的数目为0.1NA
D.60g乙酸与足量乙醇发生酯化反应时断裂C—O键的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学学习小组利用如图装置来制取乙酸乙酯。
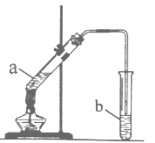
I.实验过程:向试管a中加入碎瓷片,3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸,最后加入2mL乙酸,按图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到b试管中的液面上。
II. 已知化学方程式:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
III.查阅资料得知:乙酸乙酯不溶于水,密度比水小,且有香味
请回答下列问题:
(1)试管a中加入碎瓷片,其作用是_____(填字母代号)。
A.加快化学反应速率 B.防止溶液暴沸
(2)试管b中的溶液是_____(填字母代号)。
A饱和碳酸钠溶液 B.饱和氢氧化钠溶液
(3)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层。
①乙酸乙酯在________(填“上层”或“下层”)。
②常用________操作将两层液体分离(填“过滤”或“分液”)。
(4)实验中加入乙酸的质量为2.1g,其中60%的乙酸发生酯化反应,则得到乙酸乙酯的质量为______g(计算结果保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】POCl3是重要的化工原料,某兴趣小组准备用三氯化磷、氯气、二氧化硫制备POC13,产物中还有一种遇水强烈水解的物质SOCl2,用下列装置完成实验。
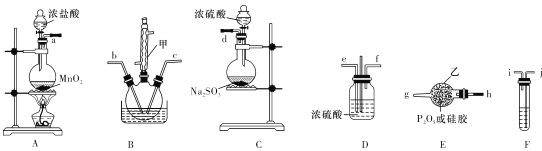
已知:PCl3熔点-93.6℃、沸点76.1℃,遇水强烈水解,易与氧气反应;POCl3遇水强烈水解,能溶于PCl3。
(1)仪器甲的名称是 ___。
(2)已知装置B制备POC13,以上仪器接口连接的顺序为a- ___b-c-g-h-d,装置F中所装试剂为 ___,装置B中发生反应的化学方程式为 ______.
(3)B中反应温度控制在60-- 65℃,其原因是 _____________
(4)用佛尔哈德法测定POC13含量:准确称取20. 20 g POCl3产品,置于盛有60. 00 ml蒸馏水的水解瓶中摇动至完全水解;将水解液配成100. 00 mL溶液,取10. 00 mL溶液于锥形瓶中;加入10. 00 mL3.200 mol/L AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;加入指示剂,用0. 200 0 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mLKSCN溶液。[已知:Ksp(AgCl) =3.2×10-10,Ksp(AgSCN) =2×10-12]
①滴定选用的指示剂是________:填字母代号),滴定终点的现象为____。
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②用硝基苯覆盖沉淀的目的是____。
③产品中POC13的百分含量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组以甲苯为主要原料,采用以下路线合成镇静催眠药物—苯巴比妥:
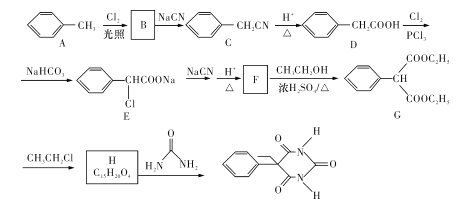
已知:R-Cl+NaCN→R-CN+NaCl。
回答下列问题:
(l)化合物B的名称是 ___。
(2)写出 H的结构简式____。H→苯巴比妥的反应类型是____。
(3)写出F→G的化学方程式____。
(4)下列说法正确的是____(填字母代号)。
A.B的核磁共振氢谱有5组峰
B.化合物E能发生取代、氧化、加成、消去等反应
C.尿素[CO(NH2)2]在一定条件下可水解生成NH3和CO2
D.苯巴比妥的分子式为C12H12N2O3
(5)F制备G时会生成副产物M( C11Hl2O4),则符合下列条件的M的同分异构体有___ 种。
①除苯环外不含其它环状结构,且苯环上有3个取代基;
②核磁共振氢谱图显示有5种化学环境不同的氢原子;
③该物质可发生银镜反应与水解反应,且l mol该物质完全水解时需要2 mol NaOH。
(6)以乙醇为原料可合成HOOCCH2CH2COOH,请设计合成路线_________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①25℃时,NaHCO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“HCO3-”);
②常温下,0.0100mol/L 盐酸的pH=___________;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为___________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=___________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨___________金刚石 (填“>”、“<”或“=”)。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K___________(填“增大”、“减少”或“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时__________溶液(填“CuSO4”或“AgNO3”);
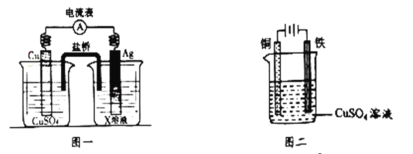
②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)关注营养平衡,合理使用药物,有利于身心健康,现有下列四种物质:
A. 维生素 B. 油脂 C. 青霉素 D. 碘酸钾
请根据题意,选择恰当的选项字母代号填空。
①在人体内提供能量的物质是___________。
②为预防甲状腺肿大,常在食盐中加入的物质是___________。
③能阻止多种细菌生长的重要抗生素是___________。
④存在于蔬菜、水果中,具有还原性的物质是___________。
(2)随着工业发展和社会的进步,人们日益关注环境污染问题。
①垃圾处理遵循无害化、减量化和资源化的原则。垃圾分类收集是实现上述原则的措施之一。贴有如图所示标志的垃圾箱收集的是___________(填字母代号):

A. 可回收物 B.有害垃圾 C.其它垃圾
②我国城市发布的“空气质量日报”中,下列物质不列入首要污染物的是___________(填字母代号):
A. 二氧化硫 B.二氧化碳 C.二氧化氮 D.可吸入颗粒物
③使用Pb2+含量超标的水,会严重危害人体健康,某冶炼厂产生了Pb2+含量超标的废水,处理此废水的方法是加入适量Na2S,使Pb2+沉淀而除去。请写出该反应的离子方程式: ___________。
(3)材料是人类生存和发展的物质基础,合理使用材料可以节约资源。
①下列生活中的常见物质,属于硅酸盐材料的是___________(填字母代号):
A. 汽车轮胎 B. 不锈钢 C. 水泥
②我国航天员穿的航天服主要是由具有密度小、强度大、耐腐蚀、柔软等优良性能的特殊材料制成,这些材料属于___________(填字母代号):
A. 镁铝合金 B. 合成纤维 C. 天然纤维
(4)某同学取一颗光亮的铁钉按如图装置做吸氧腐蚀实验。几天后观察到:试管内铁钉生锈、液面上升。此过程中正极的反应式为:O2+4e- +2H2O=4OH- ,则负极的反应式为:_________________________________。
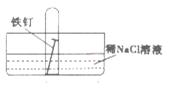
查看答案和解析>>
科目: 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应I: Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
反应Ⅱ:Al2O3(s)+3C(s) =2Al(g)+3CO(g) ΔH2=bkJ·mol-1
反应Ⅲ:3AlCl(g)=2Al(l)+AlCl3(g) ΔH3
①反应Ⅲ的△H3=____kJ/mol。
②950℃时,铝土矿(Al2O3)与足量的焦炭和C12反应可制得AlCl3。该反应的化学方程式是 _____________________________
(2)在高温条件下进行反应:2Al(l)+AlCl3 (g)![]() 3AlCl(g)
3AlCl(g)
①向图1所示的起始容积相等的两个密闭容器A、B中加入足量的Al粉,再分别充入1molAICl3 (g),在相同的高温下进行反应。图2表示A容器内的AlC13(g)体积分数随时间的变化图,在图2中画出 B容器内AlCl3 (g)体积分数随时间的变化曲线____________。
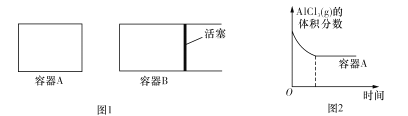
②1 100℃时,向2L密闭容器中通入3mol AlCl(g),发生反应:3AlCl(g)![]() 2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
③加入3 mol AlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。则此反应选择温度为 _____________________
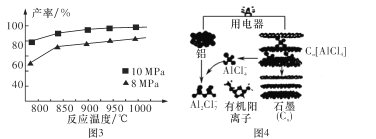
(3)铝可以用来制作快速放电铝离子二次电池,该电池以金属铝和石墨为电极,用AlCl4-、Al2Cl2-和有机阳离子组成电解质溶液,其工作原理如图4所示。
①该电池放电时,AlCl4-向 ___(填“铝电极”或“石墨电极”)方向移动。
②该电池充电时,阴极的电极反应式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7.2H2O),其主要工艺流程如下图:
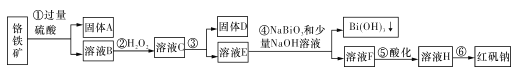
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的 pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为____(填化学式)。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5.0的目的是____。
(3)写出④反应的离子反应方程式:____。
(4)取一定质量的固体D溶解于200 mL的硫酸中,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240 mL时发生反应的化学方程式为____,固体D中含铁化合物的物质的量为____

Ⅱ.经检测该化工厂的工业废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Fe的化合价依次为+3、+2),又设计了如下工艺流程:
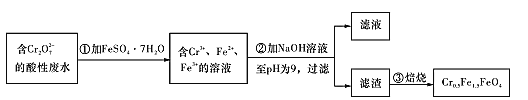
(5)第①步反应的离子方程式为____。
(6)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加FeSO4.7H2O的质量为 ___g(已知FeSO4.7H2O的摩尔质量为278 g/mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验:
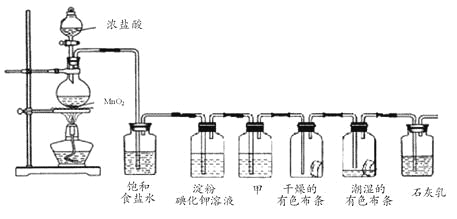
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是________________,反应的离子方程式为_____________。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放________(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为___________________________。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com