
科目: 来源: 题型:
【题目】标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_________。
(2)混合气体的平均摩尔质量是_________。
(3)CO2和CO的体积之比是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,可用于催熟果实。根据以下化学反应框图填空:
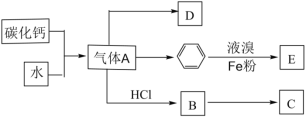
(1)写出A的电子式_______;C的结构简式_______;D中碳原子的杂化方式为_______
(2)写出苯和液溴反应生成E的化学方程式_______;其反应类型是_______;
(3)B中最多有_______个原子共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是一门以实验为基础的科学。
(1)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是________(填字母)。
A | B | C | D |
|
|
|
|
干燥氯气 | 吸收NH3 | 石油的分馏 | 制取乙酸乙酯 |
(2)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
①第Ⅰ步操作的名称是____________。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
A.将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+
B.1mol·L-1CH3COOH与1mol·L-1CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA
C.常温常压下,3.6gH2O中含有电子数为2NA
D.含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
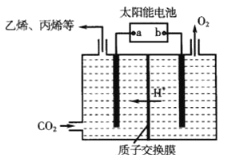
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A.选择合适的试剂,用图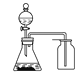 所示装置可分别制取少量CO2、NO和O2
所示装置可分别制取少量CO2、NO和O2
B.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
C.洗涤沉淀时(如图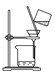 ),向漏斗中加适量水,搅拌并滤干
),向漏斗中加适量水,搅拌并滤干
D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
科目: 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。
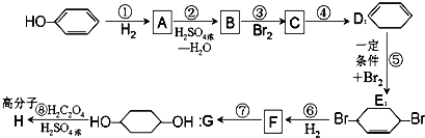
请回答下列问题:
(1)B,F的结构简式为:B___,F_______;
(2)反应①~⑦中属于消去反应的是(填代号)_______;
(3)根据反应![]() +Br2
+Br2![]()
![]() ,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__;
,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__;
(4)写出第④步C→![]() 的化学方程式(有机物写结构简式,注明反应条件)__;
的化学方程式(有机物写结构简式,注明反应条件)__;
(5)与4个不同的原子或原子团相连的碳原子称为手性碳原子;A﹣G这七种有机物分子中含有手性碳原子的是(填序号)__;
(6)核磁共振谱是测定有机物分子结构最有用的工具之一,在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目,例如:乙醛的结构式为:![]() ,其PMR谱中有2个信号峰,其强度之比为3:1,则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是__。
,其PMR谱中有2个信号峰,其强度之比为3:1,则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是__。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com