
科目: 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09 kJ·mol-1
氧化法:CH3OH(g)+![]() O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64 kJ·mol-1,则ΔH2=_________________。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为________________________________________。
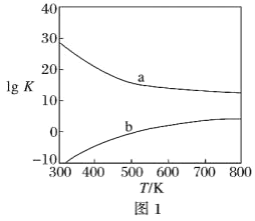
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线_____(填“a”或“b”)对应脱氢法,判断依据是_____________________________________。
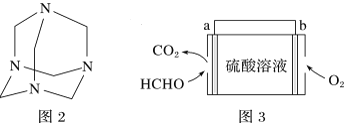
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为___________。
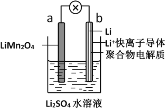
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则a极的电极反应式为_________________________________________________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为________________mg。
查看答案和解析>>
科目: 来源: 题型:
【题目】新能源汽车所用蓄电池分为铅酸蓄电池、二次锂电池、空气电池等类型。请回答下列问题:
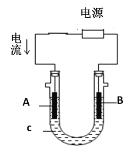
(1)2019年诺贝尔化学奖授予了为锂离子电池发展做出贡献的约翰·班宁斯特·古迪纳夫等三位科学家。如图所示为水溶液锂离子电池体系。放电时,电池的负极是_______(填a或b),溶液中Li+从______迁移(填“a向b”或“b向a”)。
(2)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
①放电时,正极的电极反应式是________________________,电解质溶液中硫酸的浓度_____(填“增大”、“减小”或“不变”),当外电路通过0.5 mol e-时,理论上负极板的质量增加_______g。
②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用________溶液,A电极的材料是_______,B电极反应式是_________。
③用该蓄电池作电源,A、B为石墨电极,c为氯化钠溶液,进行电解。如上图所示,则A电极产生的气体是________,B电极附近溶液的pH_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应叙述相符的是
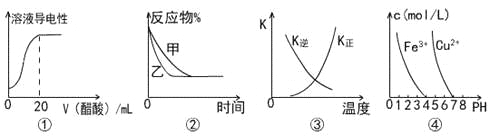
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)![]() 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
查看答案和解析>>
科目: 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
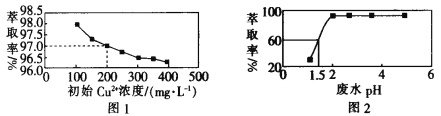
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g) ![]() 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是

A.升高温度.平衡常数增大
B.W点Y的正反应速率等于M点Y的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
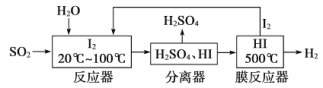
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题。
(1)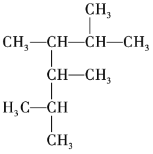 的名称为______。
的名称为______。
(2) 的名称为______。
的名称为______。
(3)3-甲基-2-戊烯的结构简式为______。
(4)1,3,5-三甲基苯的结构简式为______。
(5)某烷烃的相对分子质量为72,其一氯代物只有一种,该烷烃的结构简式为______。
(6)2,3-二甲基-2-丁烯的键线式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com