
科目: 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,如图是用烯烃A和羧酸D合成环丁基甲酸的路线。
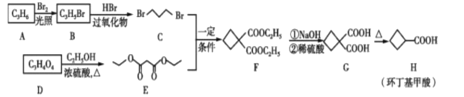
请回答下列问题:
(1)A的结构简式为____。
(2)B中官能团的名称为____、____。
(3)B→C的反应类型为____。D→E的反应类型为__________
(4)C+E→F的化学方程式为________
(5)满足下列条件的H的所有同分异构体(不考虑立体异构)共有____种,其中核磁共振氢谱有3组峰的结构简式为____。
①能使溴的四氯化碳溶液褪色
②能与NaOH溶液反应
③能与银氨溶液发生银镜反应
④不含环状结构
(6)以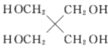 和
和![]() 为原料,选用必要的无机试剂,写出合成
为原料,选用必要的无机试剂,写出合成![]() 的路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
的路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目: 来源: 题型:
【题目】1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应:![]() 并达到平衡。
并达到平衡。
(1)平衡后,向容器中充入1mol![]() ,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)______判断该反应达已经到平衡状态。若初始时加入的![]() 为2.84g,10分钟后达到平衡时
为2.84g,10分钟后达到平衡时![]() 的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,
的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,![]() ________。
________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸三丁酯的结构简式为B(OCH2CH2CH2CH3)3,常温常压下为略带香味的油状液体,是一种重要的含硼有机物,主要用作有机溶剂、脱水剂和催化剂,其一种实验室制备的原理为H3BO3+3CH3CH2CH2CH2OH![]() B(OCH2CH2CH2CH3)+3H2O,装置如图所示(夹持装置及微波加热装置已略去):
B(OCH2CH2CH2CH3)+3H2O,装置如图所示(夹持装置及微波加热装置已略去):

实验步骤如下:
Ⅰ.向微波专用圆底烧瓶中加入磁力搅拌子,并加入6.2 g硼酸(H3BO3)和47.4 mL正丁醇(CH3CH2CH2CH2OH)以及1.0 g NaHSO4H2O;
Ⅱ.微波加热:60℃下2 min,80℃下2 min,90℃下5 min,100℃下2 min,118℃下2 min;回流分水;
Ⅲ.待反应结束后,蒸馏得产品20.2 g。
已知:正丁醇的密度为0.81 g.cm-3。
请回答下列问题:
(1)分水器使用前需检查 ___,分水器的作用是 ___(任写一条)。
(2)图中仪器X的名称为 ___,其进水口应为____(填“a”或“b”)口。
(3)为了提高转化率,常用带水剂把生成的水从反应体系中分离出。分别以下列四种物质作为制备硼酸三丁酯的带水剂,结果如表所示,该实验选择正丁醇作带水剂,优点是____。
带水剂种类 | 甲苯 | 苯 | 环己烷 | 正丁醇 |
产率/% | 78.2 | 83.4 | 80.4 | 80.5 |
(4)步骤II中需要在不同温度下进行加热,并控制好时间,加热方式采用微波加热的优点是 ___;实验过程中发现,随着微波加热时间延长,硼酸三丁酯的产率增加,但当加热时间超过13 min后,产率增加幅度明显减小,造成此现象可能的原因是___。
(5)蒸馏装置中仪器的选择和安装均正确的是____(填选项字母)。
A. 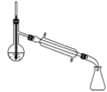 B.
B. 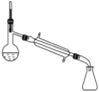 C.
C.  D.
D. 
(6)本实验中硼酸三丁酯的产率为____(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。稀土元素包括钪、钇和镧系元素。请回答下列问题:
(1)写出基态二价钪离子(Sc2+)的核外电子排布式____,其中电子占据的轨道数为 ____。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3nH2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为____;1 mol H2C2O4分子中含σ键和π键的数目之比为 ___。
②H2O的VSEPR模型为 ___;写出与H2O互为等电子体的一种阴离子的化学式_______。
③HCI和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl2H2O,HCl2H2O中含有H5O2+,结构为![]() ,在该离子中,存在的作用力有___________
,在该离子中,存在的作用力有___________
a.配位键 b.极性键 c.非极性键 d.离子键 e.金属键 f氢键 g.范德华力 h.π键 i.σ键
(3)表中列出了核电荷数为21~25的元素的最高正化合价:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
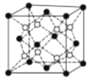
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为_____gcm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)CH2O(g)+H2O(g) H。请回答下列问题:
(1)己知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) H1=-480kJ/mol
②相关化学键的键能数据如表所示:
化学键 | O=O | H-H | O-H |
键能/kJmol-1 | 498 | 436 | 464 |
则CO2(g)+2H2(g)CH2O(g)+H2O(g) H=____________
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是____(填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_____填选项字母)
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:4的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=![]() 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
②T1℃时,反应的平衡常数Kp的代数式为Kp=_______kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的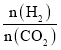 关系如图所示:
关系如图所示:
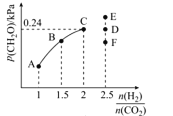
①当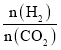 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
②当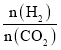 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
查看答案和解析>>
科目: 来源: 题型:
【题目】配离子的稳定性可用K不稳衡量,例如Ag(NH3)2]+的K不稳=![]() 。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=
。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=![]() (X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
(X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
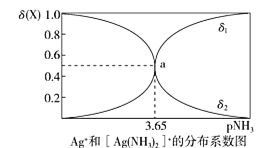
A.图中δ2代表的是δ([Ag(NH3)2]+])B.向溶液中滴入稀硝酸,δ(Ag+)减小
C.该溶液中c(NH4+)+c(H+)=c(OH-)D.该温度时,K不稳([Ag(NH3)2]+)=10-7.3
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素R、W、X、Y、Z的原子序数依次增大,R、Y同主族。m、n、q是由这些元素组成的三元化合物,0.1 molL-l q溶液常温下的pH=1;r、s、t、u是由这些元素组成的二元化合物,r常用作调味剂,t通常为液态;v是元素X的一种常见单质。上述物质的转化关系如图所示。下列说法正确的是
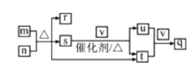
A.原子半径:R<W<X<Z<YB.n、r、t中化学键类型相同
C.u、v、q中均含有X元素D.m、s均属于碱
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②属于同种反应类型。根据图回答下列问题:
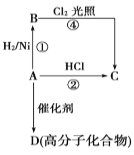
(1)写出A、B、C、D的结构简式:A______,B_______,C_______,D_______。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________,反应类型___________。
④______________,反应类型___________。
(3)工业上制取A的主要方法是_____,实验室制取A的反应条件是______,实验室制取A时,会生成黑色固体,并放出刺激性气味的气体,检验该气体可以用______溶液;黑色固体与浓硫酸反应产生该气体时,体现了浓硫酸的_____性
(4)D_____(填“有”或“没有”)固定熔点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com