
科目: 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:________。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是__________。
(3)BF3分子中中心原子的杂化轨道类型是____。又知若有d轨道参与杂化,能大大提高中心原子的成键能力,分析BF3、SiF4水解的产物中, 除了相应的酸外,前者生成BF4-而后者生成SiF62-的原因:_______________。
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为_________,其中三种元素的电负性由大到小的顺序是_______________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O710H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是______________(填字母)。

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的_____(填“立方体”“正四面体”或“正八面体”)空隙。建立如图所示坐标系,可得晶胞中A、C处原子的分数坐标,则N处的P原子分数坐标为______。若晶胞中硼原子和磷原子之间的最近核间距为a pm,则晶胞边长为____________cm。

查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6 kJ·mol-1
(g) △H1=-206.6 kJ·mol-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)若反应Ⅲ在一定温度下可自发进行,则△H3_____(填“>”“<”或“=”)0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4 kJg-1,则△H3=___kJmol-1。
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1<0中,v逆=k逆c2(
(g) △H1<0中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填“大于”“小于”或“等于”)k逆增大的倍数。
②若在1 L的密闭容器中充入1 mol CH2=CH2(g)和1 mo1O2(g),在一定温度下只发生反应I,经过10 min反应达到平衡,CH2=CH2(g)的转化率为40%,则010 min内v(O2)=_________,![]() =______(保留两位有效数字)。
=______(保留两位有效数字)。
(4)下列有关环氧乙烷制备的说法正确的是_____(填字母)。
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水

(5)一种以天然气为燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。
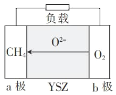
a极上的电极反应式为_____;若电路中转移0.1 mol电子,则消耗标准状况下CH4的体积为_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
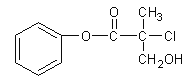
A.1mol A最多能与4mol H2发生加成反应
B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向盛50mL0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100mol·L-1醋酸铵溶液,测得溶液pH随时间变化如图所示。已知Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
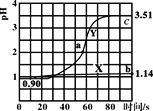
A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中溶液各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO-)<c(NH4+)
C.a点溶液中n(Cl-)+n(CH3COO-)+n(OH)-n(NH4+)=0.01mol
D.b点溶液中水电离的c(H+)是c点的102.37倍
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】探究铝片与Na2CO3溶液的反应:
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 H2和CO2) |
下列说法正确的是( )
A.Na2CO3溶液中存在水解平衡:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑
C.对比Ⅰ、Ⅲ,说明 Na2CO3溶液能破坏铝表面的保护膜
D.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
查看答案和解析>>
科目: 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
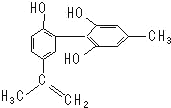
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4mol、7mol
D.该分子中的所有原子可能共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
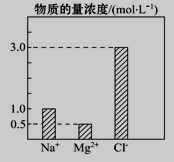
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L SO3中含原子数为0.2NA
B.10 mL 12 mol/L 浓盐酸与足量MnO2加热反应,制得氯气的分子数0.03NA
C.0.1 mol CH4与0.4 mol Cl2在光照下充分反应,生成CCl4的分子数为0.1NA
D.常温常压下,6 g乙酸中C-H键的数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式为![]() ,下列关于邻二乙烯苯的说法正确的是( )
,下列关于邻二乙烯苯的说法正确的是( )
A.1mol 邻二乙烯苯含有5 mol碳碳双键
B.所有的原子不可能在同一平面
C.能发生加成反应,也能发生取代反应,不能发生聚合反应
D.苯环上的二氯取代物有4种(不含立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com