
科目: 来源: 题型:
【题目】Ⅰ.在水溶液中橙色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________色,因为_________________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈_____色,因为________。
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为_______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为______。
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
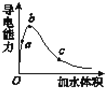
①a、b、c三点醋酸电离程度由大到小的顺序为____;a、b、c三点对应的溶液中c(H+)最大的是_____。
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=____。
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(__)。
A.c(H+) B.溶液pH C.![]() D. CH3COOH分子数
D. CH3COOH分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】宋代张杲《医说》引《集验方》载:每每外出,用雄黄桐子大,在火中烧烟薰脚绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。雄黄的结构如图所示,下列说法错误的是
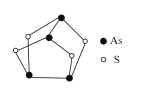
A.雄黄中硫的价态为-2价
B.古代熏蒸的消毒原理与H2O2、酒精相同
C.佩戴药剂香囊是中医独特的防疫措施
D.生活中也可使用火、盐水消毒器具
查看答案和解析>>
科目: 来源: 题型:
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
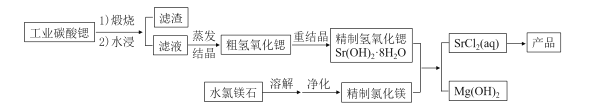
(1)锶与钙元素同主族。金属锶应保存在_______中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为__________。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是______。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为____________,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是_____。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2 除杂,写出该过程的离子方程式__________。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是______(填标号)。
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。
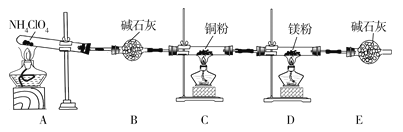
(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
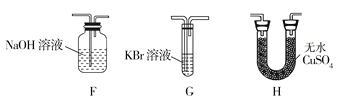
①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最慢的是( )
A.v(A)=0.20 mol·(L·min)-1B.v(B)=0.45 mol·(L·s)-1
C.v(C)=0.30 mol·(L·min)-1D.v(D)=0.35 mol·(L·min)-1
查看答案和解析>>
科目: 来源: 题型:
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。回答下列问题:
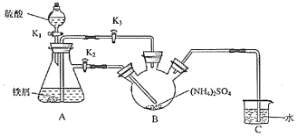
Ⅰ.制取莫尔盐:
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中__________(填仪器名称),将6.0g洁浄铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2molL-1稀硫酸后关闭K1.A装置中反应的离子方程式为______________。
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为___________________________________。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、___、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为_______________________________。
④装置C的作用为___________________,装置C存在的缺点是____________________。
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1molL-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mLKMnO4溶液。滴定反应的离子方程式为_______________________,该样品的纯度为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
B.对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
C.氨水中加入NaOH固体有利于氨气的溢出
D.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
查看答案和解析>>
科目: 来源: 题型:
【题目】下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )

A.氢氧化钠的物质的量浓度为1 mol·L-1
B.曲线b是氢氧化钠滴定盐酸的滴定曲线
C.P点时反应恰好完全,溶液呈中性
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】I.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。
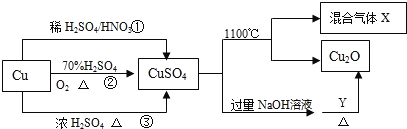
(1)比较途径①②③,途径_______更好地体现了绿色化学思想,其反应的化学方程式:_____
(2)CuSO4在1100℃分解所得气体X可能是SO2、SO3和另一种气体的混合气体,请写出相关化学方程式:________________________。
II.工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如下图
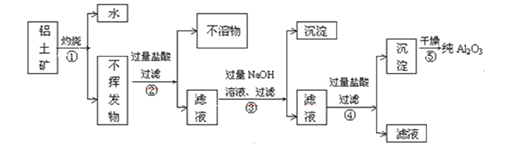
(1)指出图中操作错误的两处是:________________。
(2)步骤②过滤的不溶物是:__________________。
(3)写出步骤③反应(得到④滤液)的主要离子方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com