
科目: 来源: 题型:
【题目】已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=2H2O(l)+CO2(g) ΔH=-890kJ·mol-1
(1)已知H—H键的键能为436kJ·mol-1,O=O键的键能为496kJ·mol-1,H—O键的键能为463kJ·mol-1,根据上述数据通过键能可直接计算出反应___(填反应序号)的焓变,由反应①②可得出反应比H2O(l)=H2O(g)的焓变ΔH=___。
(2)根据题干可计算出CO2(g)+4H2(g)=CH4(g)+2H2O(g)的焓变ΔH=___。
(3)在①②③三个热化学方程式中,可表示燃烧热的热化学方程式的是___(填序号)。标准状况下,取甲烷和氢气的混合气体11.2L,完全燃烧后恢复到常温,放出的热量为263.8kJ,则混合气体中甲烷和氢气的体积比为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-=2O2-)。
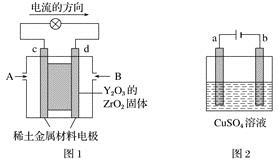
(1)c电极的名称为___,d电极上的电极反应式为___。
(2)如图2所示用石墨电极电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为___。
(3)若a电极产生56mL(标准状况)气体,则所得溶液中的c(H+)=___(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入___(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】碲是当代高科技材料不可缺少的重要组成元素。以铋碲矿(主要含Te、Bi、Si、S等元素)为原料生产精碲的工艺流程如下:
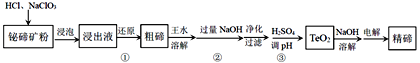
已知:TeO2是两性氧化物,微溶于水.回答下列问题:
(1)浸出液中碲以TeO2+存在,步骤①加入Na2SO3进行还原,反应的离子方程式为________。Na2SO3的实际用量比理论用量偏多,其主要原因是________。
(2)王水是由约3体积浓盐酸和约1体积浓硝酸配制而成。在实验室中配制王水所用的玻璃仪器除玻璃棒外还有________。王水溶解粗碲时,加入的碲粉与生成的NO的物质的量之比为________。
(3)粗碲中仍含有硅元素,净化时加入CaCl2溶液可以除去硅元素,硅元素将以________(填化学式)形式被除去。
(4)步骤③,将Na2TeO3转化为TeO2,反应的离子方程式是________。
(5)电解时,精碲在______极析出,电解产物中可循环使用的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
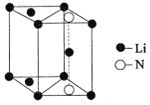
查看答案和解析>>
科目: 来源: 题型:
【题目】连二次硝酸(H2N2O2)是二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为___。
(2)常温下,用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
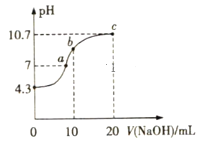
写出H2N2O2在水溶液中电离的主要方程式:___。
②c点时溶液中下列离子Na+、OH-、N2O22-、HN2O2-,浓度由大到小的顺序为___。
③b点时溶液中的溶质为___。
④a点时溶液中c(Na+)___c(HN2O2-)+c(N2O22-)(填“>”“<”或“=”)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可得到黄色的连二次硝酸银沉淀,向该体系中滴加硫酸钠溶液,白色沉淀和黄色沉淀共存时,该体系中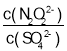 =___[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
=___[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.pH=a的氨水,稀释10倍后,其pH=b,则a<b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH<7
C.向10mL0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D.向10mLpH=11的氨水中加入10mLpH=3的H2SO4溶液,混合液pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
(1)仪器A的名称是_______________________。
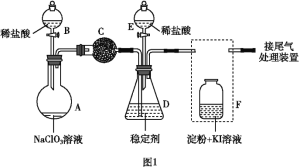
(2)安装F中导管时,应选用图2中的___________________。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I+8H+=2Cl+5I2+4H2O 2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______g/L(用含字母的代数式表示,计算结果化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T细胞淋巴瘤,其合成路线如图所示:
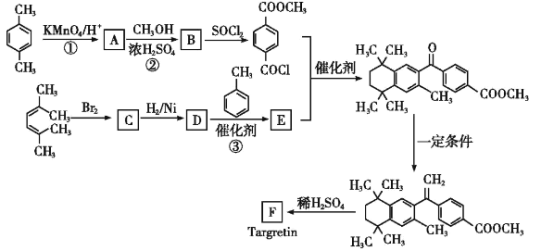
已知:
ⅰ.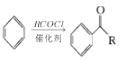
ⅱ.![]()
ⅲ.RCOOH![]() RCOCl(R表示烃基)
RCOCl(R表示烃基)
(1)反应①的反应类型是__。
(2)反应②的化学方程式:__。
(3)C的核磁共振氢谱图中有__个峰。
(4)反应③的化学方程式:__。
(5)F的分子式是C24H28O2。F中含有的官能团:__。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构):__。
结构):__。
a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(7)已知:![]() (R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) ΔH1=-Q1kJ·mol-1
H2(g)+Br2(g)=2HBr(g) ΔH2=-Q2kJ·mol-1
有关上述反应的叙述正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出Q1热量
D.1molHBr(g)具有的能量小于1molHBr(l)具有的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)能自发进行,可用于生产N2H4。下列有关说法正确的是( )
A.该反应的ΔH>0,ΔS<0
B.每生成1molN2H4转移2mol电子
C.室温下,向0.1mol·L-1NaClO溶液中加水,溶液pH减少
D.N2H4、O2和KOH溶液组成的燃料电池,负极反应为N2H4-4e-=N2+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com