
科目:gzhx 来源: 题型:阅读理解
| ① | ② |
科目:gzhx 来源: 题型:阅读理解
| ① | ② |
科目:gzhx 来源: 题型:阅读理解
| A | B |
科目:gzhx 来源: 题型:阅读理解
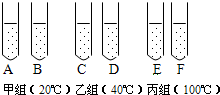 阅读下列材料:将某种玉米子粒浸种发芽后研磨匀浆、过滤,得到提取液.取6支试管分别加入等量的淀粉溶液后,分为3组并分别调整到不同温度,如图所示,然后在每支试管中加入等量的玉米子粒提取液,保持各组温度30分钟后,继续进行实验(提取液中还原性物质忽略不计):
阅读下列材料:将某种玉米子粒浸种发芽后研磨匀浆、过滤,得到提取液.取6支试管分别加入等量的淀粉溶液后,分为3组并分别调整到不同温度,如图所示,然后在每支试管中加入等量的玉米子粒提取液,保持各组温度30分钟后,继续进行实验(提取液中还原性物质忽略不计):科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:阅读理解
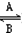 Fe3+的转化,A中Fe2+做
Fe3+的转化,A中Fe2+做科目:gzhx 来源: 题型:阅读理解
| 常温 |
科目:gzhx 来源: 题型:阅读理解
| ① | ② |
科目:gzhx 来源: 题型:阅读理解
阅读下列材料:
[材料一] 五千年中华文明成就辉煌,但在一定的条件下,也会成为中国向前发展的包袱。先民修筑了万里长城,抵御了北方游牧民族的侵扰,但也限制了自己的视野和对外交往。先民开凿了大运河,沟通了中国南北,但这对于封建统治者来说,主要是为了加强中央集权,满足了专制者游玩的需要。运河往来最多的是官吏们的游船和运送皇粮的漕船。中国拥有“四大发明”,这固然是中华民族的奇迹和骄傲,但是罗盘针可以导航亦可看风水;火药可以制造喜庆的鞭炮亦可制造杀人的武器。更为关键的似乎是文化的取向,中国有远航,郑和下西洋早在哥伦布诞生之前,但主要的目的不在于开辟国际贸易,对于商品经济的发展和提高生产力没有显而易见的深远的促进作用。
[材料二] 中国数千年的文明史,古圣贤的道德、教诲、祖宗的制度的成法,是古代辉煌的象征,同时也是进取的阻力。立论,言必称三代;著文,开篇子日诗云;行事,祖宗成法不可更改。因循守旧,不思变革,是我们伟大民族的另一种“色彩”。
——以上材料均摘自《中西对比500年》
请回答:
(1)根据材料一分析中华文明的特征,并再举—个例子加以说明(不能引材料中的史实)
(2)材料中所提到的火药与罗盘针的发明对欧洲社会的进步、世界文明的发展有何作用?
(3)根据材料二分析说明四大发明没有起到推动中国社会进步的原因。
(4)科学技术在西欧和中国的不同作用说明了什么?
科目:gzhx 来源:2011-2012学年山东省临清三中高一第三次月考化学试卷 题型:填空题
(8分)阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行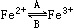 的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做 _剂,具有 性。
(3)已知:氧化性Cl2> Br2> Fe3+, 还原性Fe2+>Br- >Cl-,则向0.2mol/L 1LFeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是 ,此反应的离子方程式: 。
科目:gzhx 来源:2014届山东省高一第三次月考化学试卷 题型:填空题
(8分)阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行 的相互转化,在A过程中,Fe2+做
剂,在B过程中,Fe3+做
剂。
的相互转化,在A过程中,Fe2+做
剂,在B过程中,Fe3+做
剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做 _剂,具有 性。
(3)已知:氧化性Cl2 > Br2 > Fe3+, 还原性Fe2+ >Br- >Cl-,则向0.2mol/L 1LFeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是 ,此反应的离子方程式: 。
科目:gzhx 来源:2013届海南省高二上学期教学质量监测三化学(文)试卷 题型:填空题
(10分)阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
⑴  在人体中进行的转化时,
在人体中进行的转化时,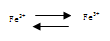 ①中的Fe2+作_____________剂,②中的Fe3+作__________剂;
①中的Fe2+作_____________剂,②中的Fe3+作__________剂;
⑵ “服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中
作__________剂,具有____________性;
⑶ 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转
化成亚铁盐。此反应的离子方程式为_________________________________________。
科目:gzhx 来源:2011-2012学年海南省嘉积中学高二上学期教学质量监测三化学(文)试卷 题型:填空题
(10分)阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+ ,有利于人体吸收。
,有利于人体吸收。
⑴
|
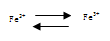 ①中的Fe2+作_____________剂,②中的Fe3+作__________剂;⑵ “服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中
①中的Fe2+作_____________剂,②中的Fe3+作__________剂;⑵ “服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中科目:gzhx 来源: 题型:阅读理解
(8分)阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做 _剂,具有 性。
(3)已知:氧化性Cl2 > Br2 > Fe3+,还原性Fe2+ >Br- >Cl-,则向0.2mol/L 1LFeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是 ,此反应的离子方程式: 。
科目:gzhx 来源: 题型:阅读理解
胃是人体消化系统中的关键部位,它容纳了我们吃下的一切食物,肩负着重要的消化任务,胃通过两种途径来完成对食物的消化任务。一是利用胃黏膜分泌出的胃液(其中含有胃蛋白酶)将食物消化,例如使蛋白质降解为易于吸收的物质;二是利用胃液中的胃酸(0.2%—0.4%的盐酸),杀死食物里的细菌,确保胃和肠道的安全,同时增加胃蛋白酶的活性,帮助消化。可见胃酸对人体来说是相当重要的。
但是,人体中胃酸的量不能过多或过少,它必须控制在一定的浓度范围内(即0.2%—0.4%)。否则,当胃酸过多时就会出现“咯酸水”“烧心”“胃部隐隐作痛”等症状,严重的会降低食欲,消化不良,进而引发胃溃疡等多种形式的胃病。胃酸过少时,也会使消化作用减退,从而导致营养不良或恶性贫血。
当胃酸过多时,通常用“小苏打”“胃舒平”等药物进行治疗。小苏打的成分是碳酸氢钠,胃舒平中含有氢氧化铝。它们都能和胃液中的胃酸发生离子反应,从而中和过多的胃酸。
当胃酸过少时,医生通常给病人服用适量的酵母片促进胃液的分泌,增进食欲;也可服用适量的稀盐酸(0.3%左右),调节胃液的pH到正常范围(0.9—1.5),恢复胃的正常消化功能。
完成下列问题:
(1)写出用小苏打或胃舒平治疗胃酸过多的离子方程式。
(2)医生忠告:胃溃疡患者治疗胃酸过多时不能服用小苏打片,为什么?
(3)当进行X光透视时,医生让病人服“钡餐”(BaSO4),能否用碳酸钡代替硫酸钡?写出离子方程式并解释。(提示:Ba2+有毒)_____________________________________。
科目:gzhx 来源: 题型:阅读理解
锡、铅两种元素的主要化合价是+2和+4,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡离子有强还原性,+4价铅元素的化合物有强氧化性。例如:Sn2+还原性比Fe2+还原性强。PbO2的氧化性比Cl2氧化性强。
锗的单质晶体是一种良好的半导体材料,广泛应用于电子工业。锗可以从燃烧的烟道灰中提取,提取过程如下:

(1)试写出上述过程中各步反应的化学方程式:②________________________________;④___________________________________。
(2)写出下列反应的化学方程式
①氯气跟锡共热:____________________________________________。
②氯气跟铅共热:____________________________________________。
③二氧化铅跟浓盐酸共热:____________________________________。
(3)能说明Sn2+还原性比Fe2+还原性强的离子方程式是___________________________。
科目:gzhx 来源:2011-2012年广东省汕头市高一上学期期中考试化学试卷 题型:填空题
(8分) 阅读下列材料后,完成相应问题。
一个体重50 kg的健康人,含铁2 g。这2 g铁在人体中不以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子(亚铁离子)易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可以使食物中的铁离子(三价铁离子)变成亚铁离子,以利于铁的吸收。
(1)人体中经常进行Fe2+ Fe3+的转化,A中Fe2+被__________,B中Fe3+作__________剂。
Fe3+的转化,A中Fe2+被__________,B中Fe3+作__________剂。
(2)从“服用维生素C,可以使食物中的铁离子变成亚铁离子”这句话分析出维生素C在这一反应中作__________剂,具有__________性
科目:gzhx 来源:2011-2012学年河北省魏县一中高一上学期期中考试化学试卷 题型:填空题
(8分)阅读下列材料后,回答相应问题。
一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。
(1)人体中经常进行 的转化,A中Fe2+做 剂,B中Fe3+做 剂。
的转化,A中Fe2+做 剂,B中Fe3+做 剂。
(2) “服用维生素C,可使食物中的三价铁离子还原成二价铁离子。”这句话指出维生素C在这一反应中做 剂,具有 性。
科目:gzhx 来源: 题型:阅读理解
(10分)阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
⑴  在人体中进行的转化时,
在人体中进行的转化时,①中的Fe2+作_____________剂,②中的Fe3+作__________剂;
⑵ “服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中
作__________剂,具有____________性;
⑶ 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转
化成亚铁盐。此反应的离子方程式为_________________________________________。