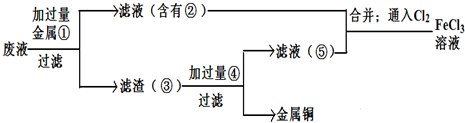
科目:gzhx 来源: 题型:
| ||
| ||
| ||
| ||
科目:gzhx 来源: 题型:解答题
 2H2↑+O2↑
2H2↑+O2↑ 2Fe+3CO2
2Fe+3CO2 Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O 6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.
6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.科目:gzhx 来源:不详 题型:问答题
| ||
| ||
| ||
| ||
科目:gzhx 来源:2010-2011学年广东省江门市台山一中高一(上)期中化学试卷(解析版) 题型:解答题
 2H2↑+O2↑
2H2↑+O2↑ 2Fe+3CO2
2Fe+3CO2 Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O 6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.
6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.科目:gzhx 来源: 题型:


科目:gzhx 来源:2013届河北省邯郸一中高三9月月考化学化学试卷(带解析) 题型:填空题
(11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
Ⅰ. MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
Ⅱ. MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
请回答下列问题:
①下列关于反应Ⅰ的说法不正确的是 。
| A.被氧化的元素是Cu和S |
| B.MnO4-是氧化剂,Cu2S既是氧化剂又是还原剂 |
| C.氧化剂与还原剂的物质的量之比为8∶5 |
| D.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol |
科目:gzhx 来源:2012-2013学年河北省高三9月月考化学化学试卷(解析版) 题型:填空题
(11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
Ⅰ. MnO4- + Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
Ⅱ. MnO4- + CuS + H+ → Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
请回答下列问题:
①下列关于反应Ⅰ的说法不正确的是 。
A.被氧化的元素是Cu和S
B. MnO4-是氧化剂,Cu2S既是氧化剂又是还原剂
C.氧化剂与还原剂的物质的量之比为8∶5
D.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol
E.氧化性的强弱关系是: MnO4-> Mn2+> Cu2+
②用单线桥表示反应Ⅱ中电子转移的数目和方向: MnO4- + CuS
(2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应:
氧化反应: H2O2 - 2e-==2H++O2↑
还原反应: MnO4-+5e-+ 8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式: 。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的氧化性强弱的结论是 。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应放出气体。其可能的原因是: 。
科目:gzhx 来源: 题型:
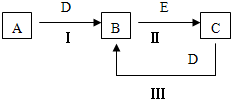 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.



科目:gzhx 来源: 题型:阅读理解
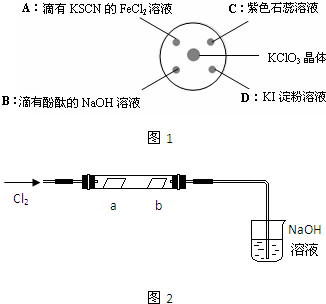
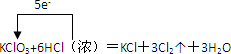
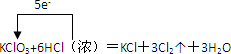
| ||
| ||
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| ||
| ||
| ||
| ||
| ||
科目:gzhx 来源: 题型:
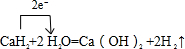
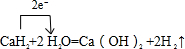
科目:gzhx 来源: 题型:
18 8 |
18 8 |


科目:gzhx 来源: 题型:
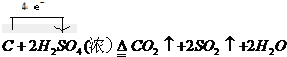
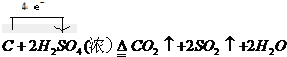
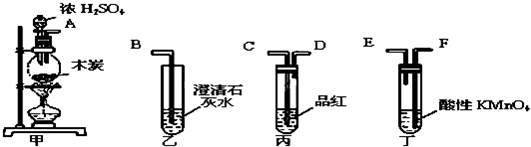
科目:gzhx 来源: 题型:
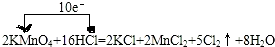
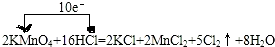
科目:gzhx 来源: 题型:
| ||
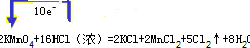
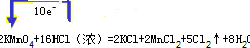
科目:gzhx 来源: 题型:


| +6 |
| Cr |
| +6 |
| Cr |
科目:gzhx 来源: 题型:


科目:gzhx 来源: 题型:
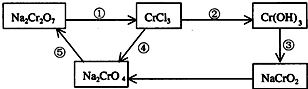 (1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=
(1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n= (用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是
(用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是科目:gzhx 来源: 题型: