
题目列表(包括答案和解析)
1、
 (2009·湛江)取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题:
(2009·湛江)取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题:
(1)当加入196g稀硫酸时,放出气体的质量为 g。
(2)计算加入的稀硫酸溶液溶质的质量分数为 。
(3)试通过计算求出加入98g稀硫酸即A点)时烧杯中溶液溶质的质量分数。 (写出计算过程)
综合检测题
2、差量法
若题给条件不是某种始量或终量,而是过程前后始量与终量的差值,用“差量法”求解十分简便。‘‘差量法’’的关键是分析过程前后形成差值的原因,找出差值与已知量、未知量的关系。
变式训练三
1、守恒法
利用化学反应前后某元素的质量守恒或某种原子(或原子团)的数目和质量守恒,可以使化学计算化难为易,收到事半功倍的效果。在应用“守恒法”时,要注意巧妙地选择两状态中总值不变的物理量建立等式,不纠缠中间过程。只考虑始终状态,实际上是整体思维在化学中的作用。
2、常见的题型有:
(1)有关纯净物的化学方程式的计算,即:
1)已知反应物(或生成物)的质量,求生成物(或反应物)的质量;
2已知一种反应物(或生成物)的质量,求另一种反应物(或生成物)的质量。
(2)含杂质(杂质不参加反应)的计算
化学方程式反映的是纯净物间的质量关系,若遇到不纯物时,应先把不纯物的质量换算成纯净物质量。
纯物质的质量==不纯物质的质量×纯度=不纯物质的质量×(1- 杂质的质量分数)
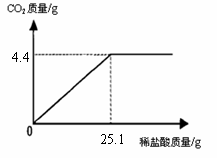 [例3](2009·连云港)某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品9.3 g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
[例3](2009·连云港)某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品9.3 g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中碳酸氢钠的质量分数。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
[答案]解:设样品中碳酸氢钠的质量为x, 生成氯化钠的质量为y
NaHCO3 + HCl === NaCl + CO2↑+ H2O(1分)
84
58.5 44
x
y 4.4 g
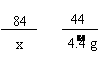
==
x = 8.4 g 
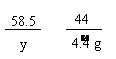

==
y = 5.85 g 
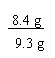

(1) 样品中碳酸氢钠的质量分数为:
×100% = 90.3%
(2) 恰好完全反应时,所得溶液中溶质的质量分数为:
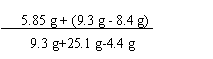
×100% = 22.5%
答:略(或其他合理解法)。
[解析]解题的关键是找到已知量(二氧化碳的质量)及反应的关键所在,从图中可知,当消耗掉25.1g稀盐酸时,反应恰好完全,产生二氧化碳的质量为4.4g,再根据二氧化碳的质量可以求出其它物质的质量。
[规律小结]利用化学方程式进行计算的方法与技巧
1、根据化学方程式计算的一般步骤
1根据题意设未知量(用x,Y等字母表示);
2写出正确的化学方程式;
3求出有关物质间的质量比(相对原子质量和或相对分子质量和),并写在相应化学式的下边;
4把已知量和未知量写在相应质量比的下边;
5列出比例式,求未知数;
6简明写出答案。
1、(2008·南通)2008年5月12日四川汶川大地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒。亚氯酸钠(NaClO2)是一种重要的消毒剂。试计算:
(1)亚氯酸钠中Na、Cl、O三种元素的质量之比为_______________。
(2)现要配制质量分数为16%的亚氯酸钠消毒液1500 kg,需要亚氯酸钠________kg。
3、溶质质量分数计算的类型
(1)溶质、溶剂、溶液的质量与溶质的质量分数的相会换算
(2)溶质的质量分数与溶液体积、密度的有关换算
溶液的质量==溶液的体积×溶液的密度
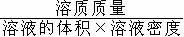
溶质的质量分数=
×100%
(3)溶液的稀释与浓缩的计算
稀释(浓缩)前后溶质的质量不变,即:
浓溶液的质量×浓溶液中溶质的质量分数==稀溶液的质量×稀溶液中溶质的质量分数
[例2](2009·泰安)制作“叶脉书签”需要lOOg溶质质量分数为10%的氢氧化钠溶液。请问:
(1)配制时需要氢氧化钠固体的质量是
g.水的质量是
g;
(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液质量是
g。
[答案](1)10 90 (2)50
[解析](1)氢氧化钠的质量=100g×10%=10g,水的质量=100g-10g = 90g
(2)设需要20%的氢氧化钠溶液的质量为x
20%x=100g×10%
X=50g
[规律小结]溶质的质量=溶液的质量×溶质的质量分数,解答稀释题的关键是利用稀释前后溶液中溶质的质量不变。
变式训练二
2、溶解度与溶质质量分数的比较
|
|
溶解度 |
溶质的质量分数 |
|
意义 |
物质溶解性的量度,受外界温度影响 |
表示溶液中溶质质量的多少,不受外界条件影响 |
|
溶剂量要求 |
100g |
无要求 |
|
溶液是否饱和 |
一定达到饱和 |
不一定 |
|
计算公式 |
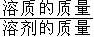 溶解度=
×100% 溶解度=
×100% |
 ×100% ×100% |
|
单位 |
克(g) |
1 |
|
联系 |
 饱和溶液中 饱和溶液中 溶质的质量分数= ×100%  |
1、溶液中溶质的质量分数
溶质质量分数是溶质质量与溶液质量之比。
计算公式:
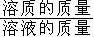
溶质的质量分数==
×100%
2、(2009·海南)三聚氰胺化学式为C3H6N6)是一种化工原料,有轻微毒性,计算:
(1) 三聚氰胺相对分子质量:
(2)三聚氰胺中碳、氢、氮元素的质量比:
(3)三聚氰胺中氮元素的质量分数(精确到0.1%)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com