
题目列表(包括答案和解析)
4.2004年3月,我国在世界上首先用二氧化碳作为原料生产出了一种无毒、阻气、透明、全降解塑料--二氧化碳聚合物。有关其生产和使用的说法错误的是 ( )
A.可以减少二氧化碳的排放,减缓温室效应
B.可以充分利用丰富的廉价资源生产塑料
C.该塑料可广泛应用于医药和食品包装、一次性餐具等方面
D.该塑料的应用可减少臭氧层的破坏
3.两只完全相同的烧杯,分别装有质量相等的浓盐酸和浓硫酸,将它们在空气中放置一段
时间,在这过程中 ( )
A.浓盐酸会吸收空气中的水 B.浓硫酸会吸收空气中的水
C.浓盐酸中溶质的质量分数逐渐增大 D.浓硫酸中溶质的质量分数逐渐增大
2.氢气是一种高能燃料,下列微粒中能保持氢气化学性质的最小粒子是( )
A.H B.H+ C.H2 D.H2O
1.物质是变化的,我们生活在多姿多彩的物质世界里。下列变化中没有新物质生成的是( )
A.白雪缓慢消融 B.葡萄酿成红酒 C.石蕊遇碱变蓝 D.铜器锈蚀变绿
31.(8分)随着社会的进步,我国的汽车工业发展迅速。现在汽车的安全性增加了,尾气的排放更加符合国际标准。围绕这两项内容,回答下列问题:
(1)为保证驾乘人员人身安全,增设了安全气囊,汽车的安全气囊在汽车发生一定强度的碰撞时,利用叠氮化钠(NaN3)发生分解反应,迅速产生氮气和固态钠,气体充满气囊,以达到保护驾乘人员的目的。
① 写出叠氮化钠分解反应的化学方程式______________________________________。
② 若常温、常压下,要产生70L的氮气,则需要完全分解__________g的叠氮化钠。(已知:常温常压下,氮气的密度约为1.2g/L。)
(2)在汽车尾气系统中装置催化转化器。
① 催化转化器可有效降低尾气中的CO、NO、NO2和碳氢化合物等有害物质向大气中排放。催化转化器中通常采用铂等贵重金属作催化剂。请写出CO和NO在催化剂的作用下发生反应生成CO和N2的化学方程式______________________________。
② 催化转化器能减少一些有害气体的排放,但它并不能减少CO2气体的排放。CO2气体的大量排放能引起温室效应。为降低温室效应造成的危害,有人认为,空气中二氧化碳的含量越低越好,你认为这种说法是否正确?为什么? ________________
____________________________________________________________________。
常州市二○○五年初中毕业、升学统一考试
30.(8分)北京6月2日讯,国家环保总局发布的《2004年中国环境状况公报》中指出下列内容:a.酸雨污染呈加重趋势 b.山西的临汾、阳泉、大同等三城市空气污染指数列全国113所环保城市前三位 c.七大水系中海河水系质量最差 d.我国城市人口占全国人口逾40%。由此根据所学知识回答:
(1)造成酸雨污染呈加重趋势的原因是(写一种) ________________________________。
(2)山西污染指数中首位是可吸人颗粒物,这与所处地区自然资源与工业生产直接相关。你认为造成空气中可吸人颗粒物增多的原因是(写一种)_________________________。
(3)取海河水系某支流河水分析,其主要污染物有较多悬浮物,河水呈碱性,水中含较多CO32-离子和有机物质(淀粉、蛋白质、洗涤剂等),还有大量病原体(如细菌、寄生虫等)。
① 用pH试纸测定河水酸碱度的方法是___________________________________________。
② 要除去水中的细小颗粒,可在水中加入______(填物质名称)作净水剂,然后静置处理。
③ 要除去水体中较多的CO32-离子,并使水体呈中性,可加入的物质是(写一种)_______。
④ 水体中有机物增加,水体溶解氧的能力会_______。(选填“增强”或“减弱”或“不变”)
⑤ 为有效消除水体中的病原体,可选用下列物质中的__________(选填序号)。
A.二氧化碳 B.漂白粉 C.氧气 D.石子和细砂
29.(6分)镁条在空气中易被氧化,有一根在空气中放置一段时间的镁条样品,其质量为2.56g,把该样品与足量的稀硫酸反应得到氢气0.18g。问:
(1)样品中未被氧化的镁的质量是多少?
(2)该镁条未被氧化时的质量是多少?
28.(4分)现有500mL溶质质量分数为l0%的氯化钾溶液(密度约为1.1g/mL)。问:
(1)溶液中含氯化钾多少克?
(2)向上述溶液中加入等体积的水后(水的密度为1.0g/mL),溶液的溶质质量分数变为多少?(计算结果请用百分数表示且保留一位小数)
27.(6分)以下是一些常见物质间互相转化的关系图(有些反应条件已省略):
已知高温下CO能与多种金属氧化物反应生成相应的金属和CO2。下列关系图中,A、B、X、Y均为无色气体,E、F为常见金属。
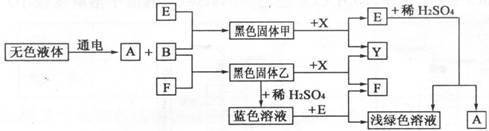
问:(1)根据上图判断B的化学式为________________;Y的化学式为________________。
(2)写出蓝色溶液与E反应的化学方程式_____________________________________。
(3)X除了与黑色固体甲、乙反应外,请再举一例说明X还能发生化合反应,写出反应的化学方程式_______________________________________________________。
26.(6分)已知在溶液中氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。现实验室中有一包白色粉末,可能是碳酸钠,也可能是氧化钙或氢氧化钙。为确定其组成,某同学设计了以下实验方案进行探究,请你按要求帮助完成探究活动。
(1)提出假设:假设① 白色粉末是碳酸钠
假设② 白色粉末是氧化钙
假设③ 白色粉末是氢氧化钙
(2)设计实验,通过实验分析进行判断并填空:
|
假设 |
设计的相关实验操作 |
实验中观察到的现象 |
假设是否成立 |
|
① |
取一定量粉末加入稀盐酸 |
没有气体产生 |
_______________ |
|
② |
取一定量粉末溶于水 |
溶液浑浊且温度升高 |
_______________ |
|
③ |
取一定量粉末溶于水,静置后取上层清液再通人二氧化碳 |
没有沉淀产生 |
_______________ |
(3)实验后思考:假定这包白色粉末是混有少量氧化钙的碳酸钠粉末,将混合物溶于水可观察到的现象是___________________________________________________;若将反应后的混合物进行固液分离,分离的方法是_______________;再将分离后的溶液蒸干,得到的固体物质是________________________(填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com