
题目列表(包括答案和解析)
表4-2离子键、共价键和金属键的比较
|
化学键类型 |
离子键 |
共价键 |
金属键 |
|
概念 |
阴、阳离子间通过静电作用所形成的化学键 |
原子间通过共用电子对所形成的化学键 |
金属阳离子与自由电子通过相互作用而形成的化学键 |
|
成键微粒 |
阴阳离子 |
原子 |
金属阳离子和自由电子 |
|
成键性质 |
静电作用 |
共用电子对 |
电性作用 |
|
形成条件 |
活泼金属与活泼的非金属元素 |
非金属与非金属元素 |
金属内部 |
|
实例 |
NaCl、MgO |
HCl、H2SO4 |
Fe、Mg |
表4-1化学键与分子间作用力的比较
|
|
化学键 |
分子间作用力 |
|
概念 |
相邻的原子间强烈的相互作用叫化学键 |
把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力 |
|
作用范围 |
分子或晶体内 |
分子之间 |
|
作用力强弱 |
较强 |
与化学键相比弱得多 |
|
影响的性质 |
主要影响化学性质 |
主要影响物理性质(如熔沸点) |
18.(2010年上海)下列实验过程中,始终无明显现象的是

 w_w w. k#s5_
w_w w. k#s5_
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
解析:本题主要考查了常见元素化合物知识。NO2通入后和水反应生成具有强氧化性的硝酸,能将亚铁盐氧化为铁盐,溶液颜色由浅绿色变为黄色,排除A;CO2和CaCl2不反应,无明显现象,符合题意,选B;NH3通入后转化为氨水,可以和AlCl3反应生成氢氧化铝沉淀,排除C;SO2通入酸化的硝酸钡中,可以被氧化为硫酸,进而生成硫酸钡沉淀,排除D。
答案:B


 w_w w. k#s5_
w_w w. k#s5_
17.(2010年上海)下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+]
B.pH=2的一元酸和pH=12的一元强碱等体积混合: [OH-]= [H+]
C.0.1 mol·L-1的硫酸铵溶液中:[NH4+]>[SO42-]>[H+]
D.0.1 mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]
解析:本题主要考查了溶液中的微粒浓度的大小比较。氨水和氯化铵混合溶液的pH=7时,根据电荷守恒知当溶液中[H+]=[OH-]时,[Cl-]=[NH4+],A错;由于pH=2的酸的强弱未知,若是强酸则正确;若是弱酸时,酸过量则溶液中[H+]>[OH-],B错;1mol.L-1的硫酸铵溶液中,铵根离子水解,但水解程度很小,根据物质的组成可知:[NH4+]>[SO42-]>[H+],C对;1mol.L-1的硫化钠溶液中,根据质子守恒可知[OH-]=[H+]+[HS-]+2[H2S],D错。
答案:C
16.(2010年福建)下列关于电解质溶解的正确判断是
A.在 的溶液中,
的溶液中, 可以常量共存
可以常量共存
B.在 的溶液中,
的溶液中, 、
、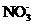 、
、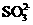 、
、 可以常量共存
可以常量共存
C.由0.1 mol·L-1一元碱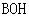 溶液的
溶液的 ,可推知
,可推知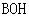 溶液存在
溶液存在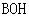 =
=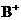 +
+
D.由0.1 mol·L-1一元酸 溶液的
溶液的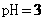 ,可推知
,可推知 溶液存在
溶液存在

解析:本题考查常见离子的 共存、弱电解质溶液的电离和水解。
共存、弱电解质溶液的电离和水解。
A.pH=12的溶液呈碱性含有比较多的OH-,不能与HCO3-共存。
B.pH=0的溶液呈酸性含有较多的H+,在NO3-离子存在的情况下,亚硫酸根离子容易被氧化成硫酸根离子,无法共存。K^S*5U.C#O%
C.0.1mol/L的一元碱的pH=10表明该一元碱是弱碱,在溶液中不能完全电离。
D.由题意可得该酸是弱酸,在NaA溶液中A-会发生水解而使溶液呈碱性。K^S*5U.C#O%
答案:D
15.(2010年安徽)将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)

 w_w w. k#s5_
w_w w. k#s5_
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
解析:Na2O2与Na2O,生成的OH-浓度相同,均约为0.2mol/L, Na2CO3因水解,使
阴离子浓度稍增大:CO32-
+ H2O  HCO3- + OH-。所以C正确。
HCO3- + OH-。所以C正确。
答案:C
14.(2010年上海)甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多 B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少 D.甲中和乙中的沉淀可能一样多
解析:表题主要考查了元素化合物知识。氢氧化铝是两性氢氧化物,能溶于氢氧化钠但不溶于氨水,既然两烧杯中都有沉淀生成,说明两烧杯中生成的都是氢氧化铝沉淀;相同体积相同pH的两溶液中的溶质是氨水大于氢氧化钠,当两者均不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠恰好时,生成的沉淀一样多;氨水和氢氧化钠都过量时,生成的沉淀氨水多;可知BD正确。
答案:BD
13.(2010年海南)常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7 B.2.0 C.12.0 D.12.4
解析:本题主要考察pH的有关计算。当酸碱发生中和时首先应判断过量问题,假设溶液体积为1L则H+和OH-的物质的量分别为0.12mol和0.1mol,因此硫酸过量,反应后溶液中H+的物质的量浓度为c(H+)= =0.01 mol·L-1,所以pH=2.0。
=0.01 mol·L-1,所以pH=2.0。
答案:B
12.(2010年海南)已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.AgCl>AgI> Ag2CrO4 B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
解析:本题主要考察溶度积常数的概念和有关计算。对应化学式相似的AgCl和AgI来说Ksp越小Ag+浓度越小,即AgCl>AgI;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,即x3=4.0×10-12,因为AgCl饱和溶液中Ag+的浓度为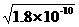 ,所以Ag2CrO4>AgCl,因此选项C正确。
,所以Ag2CrO4>AgCl,因此选项C正确。
答案:C
11.(2010年海南)把VL含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
解析:由离子反应方程式Mg2++2OH-=Mg(OH)2↓和Ba2++SO42-=BaSO4↓可知Mg2+和SO42-的物质的量分别为0.5amol和bmol,忽略溶液中的H+和OH-由电荷守恒知溶液中K+的物质的量为(b-0.5a)×2mol=(2b-a)mol。由于混合溶液分成两等份,所以选项C是错误的,正确的选项应该是D。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com