
答案:(1)H2(2)促进AlCl3水解,使晶体析出(3)HCl(4)bd(5)①bc②硝酸,过滤、洗涤
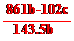
八、(本题包括1小题,共10分)
(2)升高pH至4.0~4.5的目的是 ;
(3)生产过程中可循环使用的物质是 (用化学式表示) ;
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用 (填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)为测定[A12(OH)nCl6-n。?H2O]m中的n值,进行如下实验:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg固体。此过程可能用到的 下列仪器有 ;
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作: ,
用A试剂溶解加足量AgNO3溶液操作c烘干称量为c g固体。
试剂A为 ,操作C为 、 (填操作名称)。
n= (用含a、b、c的代数式表示)。

(1)反应中副产品E是 (用化学式表示);
20.(12分)聚合氯化铝晶体[A12(OH)nCl6-n。?H2O]m是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣――铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如下:
答案:(1)Fe3++3H2Dz Fe(HDz)3+3H+。(2分)
Fe(HDz)3+3H+。(2分)
Fe3+ 会形成Fe(OH)3沉淀。(2分)
(2)pH=_1 (1分)
(3)Bi3+ Bi(HDz)3 (2分) ;3∶2 (1分)
(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
七、(本题包括1小题,共12分)
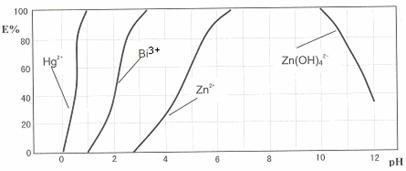
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH= 。
(3)当调节pH=2时,铋(Bi)的存在形式有: ,其物质的量之比为 。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式: 。
19.污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子配合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生配合反应:Cu2++2 H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式: 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以配合物形式被萃取分离的百分率。
答案:(1) ①0.225 75% ②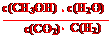 ③C D
③C D
(2)2CO2+4e-+2H2O=2CO+4OH- 不行,该反应是个焓增、熵减的反应,任何情况下都不能自发进行。
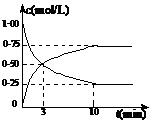
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol?L-1?min-1
氢气的转化率=
②该反应的平衡常数表达式k=
③下列措施中能使n(CH3OH)/n(CO2)增大的是 (填编号)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmolCO2和3molH2
(2)在载人航天器的生态系统中,不仅要求分离除去CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>O、△S<0)来消除CO的污染。请
你判断是否可行 ,并说出理由: 。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0 kJ?mol-1。
CH3OH(g)+H2O(g) △H=-49.0 kJ?mol-1。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com