
6.已知命题“若x+y>0,则x>0且y>0”.这个命题与它的否命题的真假是 ( )
A.原命题是真命题,否命题是假命题
B.原命题与否命题都是真命题
C.原命题是假命题,否命题是真命题
D.原命题与否命题都是假命题
5.在△ABC中,若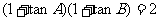 ,则角C是 ( )
,则角C是 ( )
A.45°或135° B.45° C.135° D.225°
4.设向量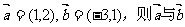 的夹角是 ( )
的夹角是 ( )
A.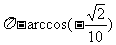 B.
B.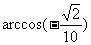
C.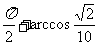 D.
D.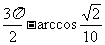
3.若点A分有向线段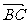 所成的比是2,则点C分有向线段
所成的比是2,则点C分有向线段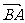 所成的比是 ( )
所成的比是 ( )
A.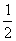 B.3 C.-2 D.-3
B.3 C.-2 D.-3
2.若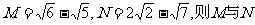 的大小为 ( )
的大小为 ( )
A.M>N B.M<N C.M=N D.无法判定
1.在平面直角坐标系中,点A(4,-2)按向量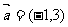 平移,得点A′的坐标是( )
平移,得点A′的坐标是( )
A.(5,-5) B.(3,1) C.(5,1) D.(3,-5)
32.(9分)少量的碘化物可用以下方法进行测定,其步骤如下:
①在中性或者弱酸性介质中先用过量的Br2将样品中的I-氧化成IO3-;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3-还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)通过上述步骤可测得碘化物中I-的含量。
(1)写出步骤①②中发生反应的离子方程式;
① ;
② 。
(2)若样品中有1mol的I-,则最后耗用Na2S2O3的物质的量为 mol。
(3)若在测定时,准确取含有KI的样品溶液25.00mL,终点时耗用0.100mol/L Na2S2O3 24mL,试计算试液中KI的含量(g/L)。
31.(8分)在常温常压下,把30mLNO2和O2的混合气体通入放置在水槽中充满水的量筒里,充分反应后,剩余5mL气体。求在原混合气体里NO2和O2各多少mL?
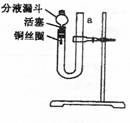
30.(14分)某课外学习小组,为探究稀HNO3能与
Cu反应生成无色的NO气体,设计了如图所示
的装置。请回答下列问题:
(1)请写出稀HNO3与Cu反应的离子方程式:
(2)写出向U形管中注入稀HNO3并将左管充满的操作过程:
。
(3)将左管充满稀HNO3的原因:
。
(4)实验开始时,反应很慢,为加快反应反应速率,应采取什么措施: 。
(5)实验中稀HNO3与Cu反应能否自动停止?为什么?
。
(6)在实验中,证明生成的无色气体是NO的操作是:
(7)为防止气体从分液漏斗上口外溢,污染空气,教师建议同学们在漏斗上口处堵一小团蘸有浓NaOH的棉花,将有毒气体吸收。其中一种气体与NaOH溶液反应生成亚硝酸盐和硝酸盐,请写出化学方程式:
29.(12分)化合物A的周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的氢氧化物可与盐酸反应,又可与NaOH溶液反应,X原子的电子式为
。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①X与H2O2反应,其产物之一是Y的单质,Y单质的电子式是 ,
Z分子的结构呈 。
②A的化学式是 。
(4)X的单质、石墨的二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应化学方程式是
 四、实验题
四、实验题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com