
3、铵盐 铵盐易溶解于水
(1)受热易分解 NH4Cl NH3↑+HCl↑ NH4HCO3
NH3↑+HCl↑ NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
(2)铵盐与碱反应放出氨气
NH4Cl+NaOH NaCl+NH3↑+H2O 注意:铵态氮肥要避免与碱性肥料混合使用
NaCl+NH3↑+H2O 注意:铵态氮肥要避免与碱性肥料混合使用
2、氮气的生产和使用
物理性质:无色无气味的气体,密度比空气小,易液化可做制冷剂
(1)与水反应
氨溶于水时,大部分氨分子和水形成一水合氨,NH3·H2O不稳定,受热分解为氨气和水
NH3+H2O NH3·H2O
NH3·H2O NH4++OH- NH3·H2
NH4++OH- NH3·H2 NH3↑+H2O
NH3↑+H2O
氨水有 分子:NH3 H2O NH3·H2O 离子:NH4+ OH- 少量H+
氨气能使湿润的红色石蕊试纸变蓝
液氨与氨水的区别:液氨 氨气的液体状态 纯净物 无移动OH-不能使湿润的红色石蕊试纸变蓝
氨水 氨气溶解于水 混合物
(2)氨可以与酸(硫酸,硝酸,盐酸)反应生成盐
NH3+HCl==NH4Cl (白烟) NH3+HNO3===NH4 NO3(白烟)
NH3+H+==NH4+
1、N2 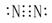
N2 电子式 N2含有三键所以比较稳定
光化学烟雾 NO2
2、硫酸的性质
浓硫酸的特性⑴吸水性:浓硫酸具有吸收附着在物质表面或内部的湿存水和结晶水的性能。是液体的干燥剂。不能干燥碱性气体NH3
⑵脱水性:蔗糖的炭化 浓硫酸滴到皮肤上处理:先用抹布抹去。再用大量的水冲洗
(3)浓硫酸的强氧化性
与铜反应:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
被还原的硫酸占反应硫酸的1/2
CuSO4+SO2↑+2H2O
被还原的硫酸占反应硫酸的1/2
与碳反应:C+2H2SO4(浓) SO2↑+ CO2↑+2H2O
SO2↑+ CO2↑+2H2O
常温下,浓硫酸使铁铝钝化


|
|
|


|
|

|
 O2
O2
H2O
NaOH
O2
O2
H2O
NaOH
O2 BaCl2
第二单元生产生活中的含氮化合物
1、接触法制硫酸
原理:(1)硫磺(硫矿石)与氧气反应生成SO2 S+O2==SO2 或 4FeS2+11O2===2Fe2O3+8SO2
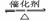 (2)SO2与氧气反应生成SO3 2SO2+O2 2SO3
(2)SO2与氧气反应生成SO3 2SO2+O2 2SO3
(3)SO3转化为硫酸 SO3+H2O==H2SO4
3、酸雨:PH〈5.6 正常性雨水PH值大约为6 ,水中溶解有CO2
硫酸性酸雨的形成原因: SO2
来源:(主要)化石燃料及其产品的燃烧。(次要)含硫金属矿物的冶炼、硫酸生产产生的废气
防治:开发新能源,对含硫燃料进行脱硫处理,提高环境保护的意识
常见的环境保护问题:酸雨:SO2 温室效应:CO2 光化学烟雾:NO2 臭氧层空洞:氯氟烃 白色垃圾:塑料垃圾 假酒:CH3OH 室内污染:甲醛 赤潮:含磷洗衣粉 CO 与NO 与血红蛋白结合 有毒 电池:重金属离子污染
2、化学性质
(1)与水反应 SO2+H2O==H2SO3 可逆反应 H2SO3的不稳定性2H2SO3 +O2==2H2SO4
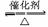 (2)还原性 2SO2+O2 2SO3
(2)还原性 2SO2+O2 2SO3
(3)漂白性:SO2 能使品红溶液褪色 原理:与有色物质结合反应生成无色物质,该物质不稳定 (暂时性漂白) 氯水 永久性漂白 原理:HClO 具有强氧化性
1、物理性质:无色有刺激性气味的有毒气体密度比空气大
20.根据要求,发挥想象,为构建社会主义和谐社会拟两条标语。要求主题鲜明,构思新颖,角度合适,语言简明,富有文采。(在10-20个字之间)(6分)
(1)(从学生角度)展现青少年的精神风貌:
(2)(从社会角度)表现对和谐社会的热情期待:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com