
22.(14分)
电子总数均为14的微粒有X、Y、Z、Q、R、W 6种,按要求填空:
(1)x、Y为两种单质,X的氧化物是制造光导纤维的主要原料,X的晶体类型为 ,该氧化物的化学式为 ;Y为分子晶体,其电子式为 。
(2)Z分子中含有4个原子,其分子的空间构型是 。
(3)Q为低价氧化物,请写出有Q生成的置换反应 。
(4)R为-2价阴离子,请写出R与钙离子组成的离子化合物与水反应的化学方程式 。
(5)W为两种相邻元素构成的-1价阴离子,其钠盐水溶液显碱性的原因是 。(用离子方程式表示)。
21.(6分)
氯碱工业中,阳极的电极反应式为 ,阴极产物为 ;若用石墨电极电解CuSO4溶液,阴阳两极均产生2.24 L气体(标准状况),则析出Cu g。
20.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为(已知Ba(AlO2):可溶)
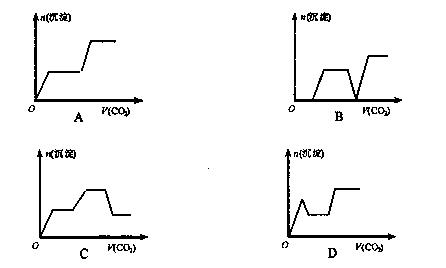
第Ⅱ卷(非选择题,共62分)
19.工业上生产Mn02和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
|
②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是 ( )
A.①中MnO2和H2SO4都是氧化剂 B.①中析出16 g S时转移l mol电子
C.②中MnSO4发生氧化反应 D.硫酸在该生产中可循环利用
18.将51.2gCu完全溶于适量浓硝酸中,在标况下收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共17.92 L,这些气体恰好能被400 mL 2.5 mol/LNaOH溶液完全吸收,溶液中生成NaNO3和。NaNO2,则原混合气体中NO的物质的量为 ( )
A.0.3 mol B.0.4 mol C.0.5 mol D.0.6 mol
17.麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植摊斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是 ( )
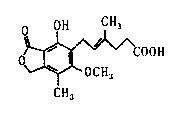 A.分子式为C17H23O6
A.分子式为C17H23O6
B.不能发生显色反应
C.在一定条件下可发生加成、取代、消去反应
D.l mol麦考酚酸最多能与3 mol NaOH反应
16.Li-Al/FeS电池是一种正在开发的车载电池,它的电池总反应方程式为:2Li+FeS=Li2S+Fe,有关该电池的下列说法中,不正确的是 ( )
A.该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe
B.K-Al合金在电池中作为负极材料
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阳极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS
15.下列说法正确的是 ( )
A.硫酸铵溶液中c(NH4+)>c(SO42-)>c((H+)>c(OH-)
B.10 mL 0.1 mol/L醋酸溶液中加入等体积、等浓度的氢氧化钠后,溶液中离子浓度由大到小的顺序是:c(Na+)=c(CH3COO-);c(OH-)=c(H+)
C.pH=3的盐酸与pH=11的氨水等体积混合c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.碳酸钠溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
14.某硝酸钙溶液的密度为1.10g/cm3,其中NO3-的质量分数为3.1%,2 L该溶液中Ca2+的物质的量约等于 ( )
A.0.28mol B.0.55mol C.0.84mol D.1.1 mol
13.下列叙述正确的是 ( )
A.原子序数越大,元素原子半径越大
B.元素原子半径越小,越容易失去电子
C.非金属元素的氢化物越稳定,沸点越高
D.稀有气体元素的质子数越大,其单质的沸点越高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com