
9.(2008扬州四调)某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据:
|
硫酸铜溶液 |
① |
② |
③ |
④ |
|
加入的无水硫酸铜(g) |
2.50 |
5.00 |
8.00 |
11.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
4.60 |
10.0 |
15.4 |
当加入a g(5<a<11)无水硫酸铜时,析出硫酸铜晶体的质量(g)为
A.1.8a-4.4 B.1.8a-8 C.1.8a-4.6 D.1.8a-0.1
[解析]根据图中数据可知,原溶液不饱和,当溶液达饱和后,相比①所增加的固体量与多析出的晶体质量成正比,当加入5.00g时,相当于比①多加2.50g,此时多析出4.50g,当加入ag时,相当于比①多加入(a-2.50)g,所以设多析出质量X,即根据 可得X=(1.8a-4.5)g,再加上①析出的0.1g,所以选 A.
可得X=(1.8a-4.5)g,再加上①析出的0.1g,所以选 A.
[答案]A
[考点分析]本题考查溶解度的相关计算。
8.(上海卢湾区2008届第一学期高三年级期末考试)常温下,在密闭容器里分别充入两种气体各0.1 mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的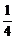 。则原混合气体可能是。
。则原混合气体可能是。
A.H2和O2 B.HCl和NH3
C.H2和Cl2 D.CO和O2
[解析]A中,根据2H2+O2=2H2O,剩余气体0.05moL的氧气;B中NH3+HCl=NH4Cl,剩余气体为零;C中,H2+Cl2=2HCl
,气体物质的量为0.2mol;D中,2CO+O2=2CO2,
剩余氧气0.05mol,生成0.1moL的二氧化碳,总气体是0.15mol。根据同温同体积气体,压强比等于物质的量比,A压强降低为开始时的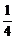 。
。
[答案]A
[考点分析]本题考查阿伏伽德罗定律的推论21世纪教育网
7.(江苏省口岸中学2009届高三年级第二次月考化学试题)25℃时,某硫酸铜溶液的质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是
A.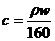 B.
B.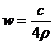 C.
C.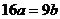 D.
D.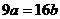
[解析]若100g溶液,溶液体积为100g/ρg.ml-1=1/10ρL,溶质的物质的量为100ω/160moL,则C=(100ω/160)moL÷(1/10ρ)L=1000ρω/160 ,AB错;
设溶液质量为x,当蒸发ag水后获得晶体,则[x(1-ω)-a]/Xω=90/160,当加入bg无水硫酸铜时获得晶体,则x(1-ω)/( Xω+b)= 90/160,联立两式得16a=9b,C正确,D错误.
[答案]C
[考点分析]本题考查溶液溶解度的计算,通过溶解度将几个常见物理量联系起来。
6.(2008-2009学年度启东市汇龙中学第一次月考)阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
⑴0.25molNa2O2中含有的阴离子数为0.5×6.02×1023
⑵7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023
⑶2.24LCH4中含有的原子数为0.5×6.02×1023
⑷250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023
⑸1L 1mol·L―1的HAc溶液中含有6.02×1023个氢离子
⑹18g D2O(重水)完全电解,转移6.02×1023个电子
⑺22.4L SO2气体,所含氧原子数为2×6.02×1023
⑻14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
A.2个 B.3个 C.5个 D.6个
[解析]⑴错,因为0.25molNa2O2中含有的阴离子0.25moL; ⑵正确,n(SiO2)=7.5/60
mol=0.125mol,每摩尔SiO2含有共价键是(1×4+2×2)/2 moL=4mol, 7.5gSiO2晶体中含有的硅氧键数为0.125×4×6.02×1023=0.5×6.02×1023
; ⑶错,不知道气体的存在的条件,无法计算;⑷错,因为氨水中存在这如下平衡NH3 + H2O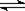 NH3·H2O
NH3·H2O 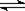 NH4++
NH4++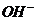 ; ⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
; ⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
[答案]A
[考点分析]以阿伏伽德罗常数的计算为背景考查:学生对物质组成的认识、晶体中共价键的数目、气体摩尔体积的应用、溶液中微粒数、转移的电子数、混合气体中共用电子对的数目21世纪教育网
5. (2008镇江期初)在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.acd D.abcd
[解析]比较a、c、d时先将不同的物理量转化为物质的量再进行比较,密度直接根据同温同压下,密度之比等于气体的式量之比,直接根据式量判断即可。
[答案]D
[考点分析]本题以物质的量为载体,考查物质的量与其他几个物理量之间的关系,同时考查学生对阿伏伽德罗定律及其推论的应用能力21世纪教育网
4.(2009浙江卷8).用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA
B.1 mol乙烷分子含有8 NA个共价键
C.58.5 g氯化钠固体中含有NA个氯化钠分子
D.在1 L 0.1 mol/L碳酸钠溶液中阴离总数大于0.1 NA
[解析]考察阿伏加德罗常数。A中NO和O2会反应生成NO2;B中乙烷共价键有7NA;
C中氯化钠含2NA个离子;D中碳酸钠因水解而使阴离子增加。
[答案]D
[考点分析]以阿伏伽德罗常数的计算为背景考查:气体摩尔体积的应用、物质中的共价键数、判断晶体类型以及水解反应对溶液中微粒数的影响。
3.(2009全国Ⅰ卷7)将15 mL 2 mol·L-1 Na2CO3溶液逐滴加入到40 mL 0.5 mol·L-1 MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4 B.3 C.2 D.1
[解析]M的化合价为+n,Na2CO3与MCln反应对应的关系式为:2Mn+ ~ nCO32 -
2 n
15×10-3×2 40×10-3×0.5
可得n=3,故选B。
[答案]B
[考点分析]本题以溶液中的离子反应为背景,考查学生物质的量应用于化学方程式的能力。
2.(2009广东卷6)设nA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是
A. 1 mol 硫酸钾中阴离子所带电荷数为nA
B. 乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3nA 个氢原子
C. 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA Fe3+
[解析]K2SO4中阴离子为硫酸根,1mol硫酸根所带电荷为2mol,A错误。乙烯和C3H6的最简式相同均为CH2,28g混合气有2molCH2,所以含4molH原子,B错误。Fe3+在溶液中发生水解,0.1molFeCl3溶液中,Fe3+的物质的量要小于0.1mol,D错误21世纪教育网
[答案]C
[考点分析]以阿伏伽德罗常数的计算为背景考查:溶液中的电荷、混合物中原子数、气体摩尔体积的应用以及水解反应对溶液中微粒数的影响。
该部分知识点主要体现在阿伏伽德罗常数的计算上,也涉及阿伏伽德罗定律及其推论。其他如一定物质的量浓度的计算、物质的量应用于化学方程式的计算往往穿插于大题之中,复习时要引起重视。
[典例精析]
1.(2009江苏高考化学)用NA表示阿伏伽德罗常数的值。下列叙述正确的是:
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的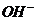 数目为0.2NA
数目为0.2NA
B.标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA
[解析]pH=13,则c(OH-)=0.1mol·L-1,n(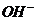 )=0.1mol,则N(OH-)=0.1NA,A错误;Cl2与NaOH 反应时,每摩Cl2转移1mol电子,所以2.24LCl2应转移0.1mol,B错误;
)=0.1mol,则N(OH-)=0.1NA,A错误;Cl2与NaOH 反应时,每摩Cl2转移1mol电子,所以2.24LCl2应转移0.1mol,B错误;
标况下,22.4L甲醇的物质的量远大于1mol,所以D错误;
[答案]C21世纪教育网
[考点分析]以阿伏伽德罗常数的计算为背景考查:溶液中微粒数、氧化还原反应中转移的电子数、混合物中原子数、以及气体摩尔体积的应用21世纪教育网
关于阿伏加德罗常数的高考试题,常常有意设置一些极易疏忽的干扰因素。在分析解答这类题目时,要特别注意下列细微的知识点:①状态问题,如水在标准状况时为液态或固态;SO3在标准状况下为固态、常温常压下为液态,戊烷及碳原子数更多的烃,在标准状况下为液态或固态。②特殊物质的摩尔质量,如D2O、T2O、18 O2 等。③某些物质分子中的原子个数,如Ne、O3、白磷等。④一些物质中的化学键数目,如SiO2、Si、CH4、P4、CO2等。⑤较复杂的化学反应中,转移电子数的求算,如Na2O2+H2O,C12+NaOH、电解AgNO3溶液等。⑥要用到22.4 L/mol时,必须注意气体是否处于标准状况。⑦某些离子或原子团在水溶液中能发生水解反应,使其数目减少。⑧注意常见的一些可逆反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com