
20.(10分)
(1) , 。
(2)
① 。
(3) 。
(4) 。
19.(12分)
(1) ; 。
(2) , , , 。
18.(14分)
(1) 。 (2) 。
(3) 。 (4) 。
(5) , 。
(6) 。
17.(6分)
(1) 。 (2) 。 (3) 。
16.(12分)
(1) 。
(2) , 。
(3)① 。 ② 。 ③ 。
(4) 。
15.(10分)
(1) 。
(2) → 。
(3) 。(4分)
(4) 。
21、(9分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
_____Cr2O72-+_____Fe2++_____H+ --_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
⑴配平第②步中离子方程式。(3分)
⑵计算工业甲醇的质量分数。(保留小数点后一位有效数字)(6分)
高三化学综合(二)答题纸2010-9-9
20、(10分)某兴趣小组为探究Na2O2滴入酚酞试液中时溶液颜色变化的原因,设计如下方案。将2角匙Na2O2加入滴有3~4滴酚酞试剂的蒸馏水(10ml)中,发现有如下现象:
①立即有大量气泡生成。
②无色透明的酚酞溶液迅速变红,振荡后,溶液中的红色褪去,重新变为无色。
③反应放出大量的热量,试管壁手触感觉很烫。
请回答:
(1)写出Na2O2与水反应的离子方程式: ,
如何检验生成的气体是氧气? 。
(2)该兴趣小组同学认为酚酞试液颜色变化的原因可能是:
① 。
②Na2O2与水反应生成的NaOH溶液浓度太大,使得酚酞变性,不显颜色。
③可能是反应放出的热量,使红色消失。
(3)假如是原因②请帮助该兴趣小组同学设计补充试验进一步说明酚酞试液褪色的原因 。
。
(4)为验证原因③,可以设计补充实验验证。请写出操作过程
。
19、(12分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现每次取100.00mL进行实验。
①第一份加入AgNO3溶液有沉淀产生。②第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。③第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩2.33g。试回答有关问题:
(1)判断K+、Cl-是否存在?K+ ;Cl- (填下列序号)。
A.一定存在 B.可能存在 C.一定不存在
(2)肯定存在的离子及在原溶液中的物质的量浓度分别为:
。
18、(14分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
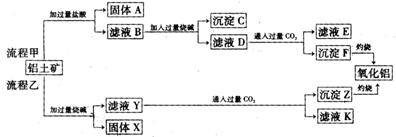
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)滤液D中通入过量的CO2的离子方程式为 。
(4)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称或化学式)。
(5)滤液E、K中溶质的主要成分是 (填化学式),用离子方程式表示
该溶液的酸碱性 。
(6)已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com