
23. (本题共8分)
(本题共8分)
 (1)
(1)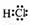 非极性
非极性
 (2)S Cl F 三 IA
(2)S Cl F 三 IA
 (3)a
(3)a
 (4)①不一定容易 ②除F2外,键长增长,键能减小 (合理即给分)
(4)①不一定容易 ②除F2外,键长增长,键能减小 (合理即给分)
18. B、D 19.A、D 20.A、B 21.C 22.A、D
B、D 19.A、D 20.A、B 21.C 22.A、D
 第Ⅱ卷(共84分)
第Ⅱ卷(共84分)
12. B 13.B 14.B 15.A 16.B 17.A
B 13.B 14.B 15.A 16.B 17.A
6. D 7.A 8.D 9.C 10.B 11.C
D 7.A 8.D 9.C 10.B 11.C
1. B 2.D 3.C 4.B 5.C
B 2.D 3.C 4.B 5.C
31. 烟气中
烟气中 是NO和
是NO和 的混合物(不含
的混合物(不含 )。
)。
 (1)根据废气排放标准,
(1)根据废气排放标准, 烟气最高允许含400mg
烟气最高允许含400mg 。若
。若 中NO质量分数为0.85,则
中NO质量分数为0.85,则 烟气中最高允许含NO__________L(标准状况,保留2位小数)。
烟气中最高允许含NO__________L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的
(2)工业上通常用溶质质量分数为0.150的 水溶液(密度1.16g/mL)作为
水溶液(密度1.16g/mL)作为 吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
 (3)已知:
(3)已知:  ①
①

 ②
②

 含2000mg
含2000mg 的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:
 NO+2HNO3→3NO2+H2O
NO+2HNO3→3NO2+H2O
 当烟气中
当烟气中 时,吸收率最高。
时,吸收率最高。

 烟气含2000mg
烟气含2000mg ,其中
,其中 。
。
 计算:(i)为了达到最高吸收率,
计算:(i)为了达到最高吸收率, 烟气需用硝酸的物质的量(保留3位小数)。
烟气需用硝酸的物质的量(保留3位小数)。
 (ii)
(ii) 烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
答案:
 (1)0.25
(1)0.25
 (2)1.64
(2)1.64
 (3)不符合 因吸收后烟气总体积减小,
(3)不符合 因吸收后烟气总体积减小, 含量仍超过
含量仍超过
 (4)(i)
(4)(i)











 (ii)
(ii)


解析:(1)1L烟气中最高允许含NO质量为400×10-3g×0.85=0.34g
其体积为
(2)此题考查物质的量浓度与质量分数的换算,可直接利用公式求解。

(3)若烟气中的其他成分不被吸收,刚好达到排放标准,但烟气中的CO2等酸性气体也能被吸收,所以吸收后烟气中NOx的含量仍超标。
























 上海 化学参考答案
上海 化学参考答案
 第I卷(共66分)
第I卷(共66分)
30. 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
 (1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol
 (保留一位小数)。
(保留一位小数)。
 (2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
 (3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
答案:
 (1)35.6
(1)35.6  (2)3
(2)3  (3)0.5
(3)0.5
[解析](1)假设有1mol O2,则
3O2 2O3
开始 1mol 0
反应 0.3mol 0.2mol
平衡 0.7mol 0.2mol
所以平均摩尔质量为: ×32g·mol-1+
×32g·mol-1+ ×48g·mol-1=35.6g·mol-1
×48g·mol-1=35.6g·mol-1
(2)此题应根据差量法计算
3O2  2O3
2O3 
开始 8L 0
反应 4.5L 3L 1.5L
(3)n(混合气体)=
设臭氧的体积分数为a,则根据氧原子守恒0.04mol·a·2+0.04mol·(1-a)·3=
解得a=0.5

29. 尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出两条合成路线)。
尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出两条合成路线)。


 完成下列填空:
完成下列填空:
 (1)写出反应类型:反应②__________________反应③___________________________
(1)写出反应类型:反应②__________________反应③___________________________
 (2)写出化合物D的结构简式:_______________________________________________
(2)写出化合物D的结构简式:_______________________________________________
 (3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:

 ____________________________________________________________________________
____________________________________________________________________________
 (4)写出反应①的化学方程式:
(4)写出反应①的化学方程式:

 ____________________________________________________________________________
____________________________________________________________________________
 (5)下列化合物中能与E发生化学反应的是_________。
(5)下列化合物中能与E发生化学反应的是_________。
 a.
a. b.
b. c.
c. d.
d.
 (6)用化学方程式表示化合物B的另一种制备方法(原料任选):
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):
 ____________________________________________________________________________
____________________________________________________________________________
答案:
 (1)氧化反应 缩聚反应
(1)氧化反应 缩聚反应
 (2)
(2)
 (3)
(3) (合理即给分)
(合理即给分)
 (4)
(4)
 (5) d
(5) d
 (6)
(6) (合理即给分)
(合理即给分)
解析:结合题目信息再采用逆推法,由尼龙-66的结构简式可推知C为:HOOC-(CH2)4-COOH,E为H2N-(CH2)6-NH2。反应①是发生了1,4-加成反应,故反应①的化学方程式为:

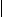 CH2=CH-CH=CH2+Cl2→CH2-CH=CH-CH2.由C到D为已二酸与氨气生成铵盐,故D为H4NOOC(CH2)4-COONH4。
Cl
Cl
CH2=CH-CH=CH2+Cl2→CH2-CH=CH-CH2.由C到D为已二酸与氨气生成铵盐,故D为H4NOOC(CH2)4-COONH4。
Cl
Cl

 C为已二酸,与C互为同分异构体且能发生银镜反应的物质中必含有醛基,一个羟基可用一个醛基和一个羟基代替,故可写为:OHC-CH-CH2-OHCH2-CH-CHO。E中含有碱性基团-NH2,故可与HCl发生反应。
OH
OH
C为已二酸,与C互为同分异构体且能发生银镜反应的物质中必含有醛基,一个羟基可用一个醛基和一个羟基代替,故可写为:OHC-CH-CH2-OHCH2-CH-CHO。E中含有碱性基团-NH2,故可与HCl发生反应。
OH
OH
28. 环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。
环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。

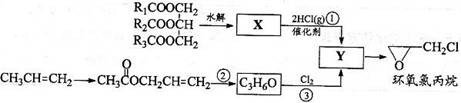
 完成下列填空:
完成下列填空:
 (1)写出反应类型:反应①_________________ 反应③___________________
(1)写出反应类型:反应①_________________ 反应③___________________
 (2)写出结构简式:X_____________________ Y________________________
(2)写出结构简式:X_____________________ Y________________________
 (3)写出反应②的化学方程式:______________________________________________
(3)写出反应②的化学方程式:______________________________________________
 (4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含
(4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含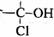 及
及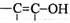 结构)
结构)
 有__________种。
有__________种。
答案:
 (1)取代反应 加成反应
(1)取代反应 加成反应
 (2)
(2)
 (3)
(3)
 (4)3
(4)3





 [解析]反应②中生成的C3H6O的结构简式为CH2===CHCH2OH,与Cl2发生加成反应得到Y:CH2-CH-CH2,所以X(CH2CHCH2)生成Y的反应为取代反应。
[解析]反应②中生成的C3H6O的结构简式为CH2===CHCH2OH,与Cl2发生加成反应得到Y:CH2-CH-CH2,所以X(CH2CHCH2)生成Y的反应为取代反应。
Cl Cl OH OH OHOH
(4)环氧氯丙烷分子中有1个不饱和度,其同分异构体应有一个双键或一个环,结合题目的限制条件可知,有如下三种情况:

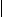 CH==CH-CH2OH CH2==C-CH2OH
CH==CH-CH2OH CH2==C-CH2OH
Cl Cl
 CH2-CH-OH
CH2-CH-OH

 CH
CH
Cl
27. 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

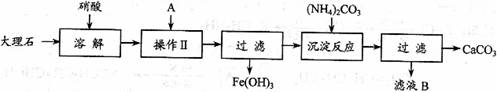
 (1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
(1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
 (2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
 (3)写出检验滤液中是否含铁离子方程式:_____________________________________
(3)写出检验滤液中是否含铁离子方程式:_____________________________________
 ______________________________________________________________________。
______________________________________________________________________。
 (4)写出加入碳酸铵所发生反应的离子方程式:________________________________
(4)写出加入碳酸铵所发生反应的离子方程式:________________________________
 写出滤液B的一种用途:_________________________
写出滤液B的一种用途:_________________________
 (5)
(5) 中一般含
中一般含 。试按下列提示完成
。试按下列提示完成 含量分析的实验设计。
含量分析的实验设计。
 试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
 实验步骤:
实验步骤:
 ①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
 (6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________
答案:
 (1)硫酸钙微溶于水
(1)硫酸钙微溶于水
 (2)除去溶液中
(2)除去溶液中 氨水
氨水
 (3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含 ;
; 或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含
 (4)
(4) 作化肥(合理即给分)
作化肥(合理即给分)
 (5)称量 过量的标准盐酸
(5)称量 过量的标准盐酸
 (6)0.1%
(6)0.1%
[解析](2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去[Fe(OH)3在弱酸性环境下就能沉淀],由因为要求溶液A的溶质是共价化合物,所以A应为氨水。(4)滤液B的溶质是NH4NO3,可以用作化肥。
(6)半滴的体积为1/50mL,则相对误差为 ×100%=0.1%
×100%=0.1%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com