
【题目】同学们发现有一种“氮气灭火装置”能利用液氮(沸点为-196℃)产生的大量氮气来灭火。他们用氮气进行如右图所示实验,却发现蜡烛未熄灭。
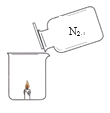
(查阅资料)氮气密度略小于空气;压强不变时,气体温度越低,密度越大。
(1)结合氮气性质分析,右图蜡烛未熄灭的原因可能是_______。
实验1:探究氮气能否用来灭火(所用容器均为隔热材料,下同)
实验编号 | 1-1 | 1-2 | 1-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛持续燃烧 | 蜡烛缓慢熄灭 | 蜡烛熄灭 |
(2)实验前有同学提出,由液氮汽化产生的氮气温度低,密度足够大,会向下流动隔 绝可燃物周围的氧气。依据实验1判断,这种假设_____(填“成立”或“不成立”)。
(3)有同学根据实验1提出新假设,氮气灭火可能与可燃物周围氮气的含量有关。可 能支持这一假设的实验现象是_______(填实验1中的实验编号)。
实验2:探究灭火与氮气含量是否有关
实验编号 | 2-1 | 2-2 | 2-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛没有熄灭 | 蜡烛缓慢熄灭 |
(4)实验2中,蜡烛所在位置氮气含量最高的是_________(填实验编号)。
(5)推测实验2-3的现象是________。
(6)反思实验2,除氮气含量外,影响蜡烛燃烧的其它可能因素是________。
(7)结合上述实验,下列关于 “氮气灭火装置”使用的说法中,合理的是______(填字母序号)。
A. 从高处向低处喷洒使用
B. 可燃物火焰熄灭后,还需持续通气一段时间
C. 在有少量排气口的封闭空间中使用时,效果好于开放空间
【答案】氮气密度略小于空气,倾倒时不能隔绝蜡烛周围的氧气 不成立 1-2 2-3 蜡烛熄灭(或蜡烛迅速熄灭,合理即可) 温度 BC
【解析】
(1)由题文知氮气密度略小于空气,倾倒时不能隔绝蜡烛周围的氧气,故填氮气密度略小于空气,倾倒时不能隔绝蜡烛周围的氧气;
(2)实验1-1和实验1-2对比,说明虽然液氮汽化产生的氮气温度低,但是密度没有大到能使烧杯下端蜡烛熄灭,仅使烧杯口端的蜡烛缓慢熄灭,在对比实验1-3中二氧化碳的灭火效果,可知这种假设不成立,故填不成立;
(3)实验1-2蜡烛熄灭而实验1-1蜡烛继续燃烧,如果氮气灭火可能与可燃物周围氮气的含量有关,说明实验1-2蜡烛周围氮气含量比实验1-1蜡烛周围氮气含量高,故填1-2;
(4)由实验2-1和2-2可知,越接近液氮,蜡烛越容易熄灭,说明越接近液氮,氮气浓度越高,可知蜡烛所在位置氮气含量最高的应该是实验2-3,故填2-3;
(5)由前分析可知越接近液氮处氮气浓度越高,蜡烛越容易熄灭,故填蜡烛熄灭(或蜡烛迅速熄灭,合理即可);
(6)液氮汽化需要吸热,越接近液氮,温度越低,温度低也可能影响蜡烛的燃烧,故填温度;
(7)
A、氮气的密度比空气小,从高处向低处喷洒使用,不能达到灭火的效果,故不符合题意;
B、可燃物火焰熄灭后,还需持续通气一段时间,避免热的可燃物和氧气接触重新燃烧,故符合题意;
C、在有少量排气口的封闭空间中使用氮气灭火时,能增加空间内氮气的浓度,灭火效果好于开放空间,故符合题意;故填BC。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源: 题型:
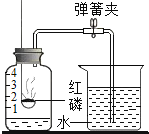
【题目】测定空气中氧气体积分数的实验装置如图所示,在集气瓶内加入少量的水,并五等分水面以上的容积,做上记号![]() 用弹簧夹夹紧乳胶管,点燃燃烧匙内稍过量的红磷后,立即伸入瓶中并把塞子塞紧,
用弹簧夹夹紧乳胶管,点燃燃烧匙内稍过量的红磷后,立即伸入瓶中并把塞子塞紧,
![]() ______ ;
______ ;
![]() 待红磷熄灭并冷却后,打开弹簧夹,观察到烧杯中的水进入集气瓶,瓶内水面最终上升约至1刻度处,由此可知氧气约占空气总体积的 ______ ;
待红磷熄灭并冷却后,打开弹簧夹,观察到烧杯中的水进入集气瓶,瓶内水面最终上升约至1刻度处,由此可知氧气约占空气总体积的 ______ ;
![]() 红磷熄灭后,集气瓶内剩下的气体主要是 ______ ,该气体 ______
红磷熄灭后,集气瓶内剩下的气体主要是 ______ ,该气体 ______ ![]() 填“支持”或“不支持”
填“支持”或“不支持”![]() 燃烧;
燃烧;
![]() 实验中红磷需稍过量,目的是 ______ ;
实验中红磷需稍过量,目的是 ______ ;
![]() 小梅同学探究了空气中氧气的含量的试验之后,又设计了如甲装置所示的实验,红磷和木炭均为足量,分别把A、B两瓶中的红磷和木炭点燃,将燃烧完毕冷却至室温后,打开C、D两处的夹子,想一想.
小梅同学探究了空气中氧气的含量的试验之后,又设计了如甲装置所示的实验,红磷和木炭均为足量,分别把A、B两瓶中的红磷和木炭点燃,将燃烧完毕冷却至室温后,打开C、D两处的夹子,想一想.
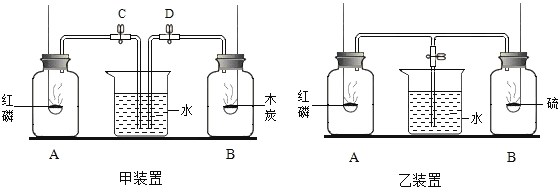
![]() 她将看到甲装置的烧杯中的水进入 ______ 瓶,原因是 ______ .
她将看到甲装置的烧杯中的水进入 ______ 瓶,原因是 ______ .
![]() 如果将甲装置改装成乙装置,反应完毕后冷却至室温后,打开弹簧夹,观察到的现象是 ______ .
如果将甲装置改装成乙装置,反应完毕后冷却至室温后,打开弹簧夹,观察到的现象是 ______ .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊分别代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,它们之间相互反应的关系如图所示。已知物质与戊的反应中:戊与甲或戊与乙的反应类型不同于其它几个反应;丙与戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。下列对应关系正确的是( )
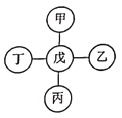
甲 | 乙 | 丙 | 丁 | 戊 | |
A | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
B | 硝酸银 | 碳酸钙 | 稀盐酸 | 氢氧化钡 | 铁 |
C | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
D | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常见的锅有陶瓷锅、铁锅、铜锅等。
(1)与陶瓷锅相比,用铜锅加热更快,利用的金属性质是_______。
(2)铁锅清洗后如未擦干,容易产生红色铁锈,该过程中发生了_____(填“物理”或“化学”)变化。
(3)铜锅加热后,锅底容易产生一层黑色的氧化铜,反应的化学方程式为________。
(4)用钢丝球清洗铜锅时,用力过大容易在铜锅上产生划痕。说明钢的硬度比铜___(填“大”或“小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国的煤炭资源丰富,但液体燃料短缺。通过“煤液化”技术,用煤炭和水制 取甲醇(CH3OH)对我国具有重要意义。主要流程如下:
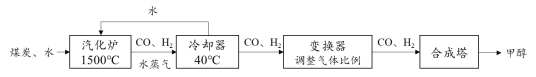
(1)冷却器里发生的是__________(填“物理”或“化学”)变化。
(2)合成塔中发生的化学反应的微观示意图如下,请在方框内补全相应微粒的图示________。

(3)下列关于甲醇生产的说法中,合理的是__________(填字母序号)
A.根据信息推测,甲醇是一种液体燃料
B.煤炭与水在常温下即可生成CO和H2
C.甲醇的生产会受到CO和H2比例的影响
(4)甲醇燃烧时发生反应:2CH3OH + 3O2![]() 2CO2 + 4H2O,若甲醇燃料的质量为32 t,则完全燃烧时消耗氧气的质量为________t。
2CO2 + 4H2O,若甲醇燃料的质量为32 t,则完全燃烧时消耗氧气的质量为________t。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是__________。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为______________。
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH_____7,证实了甲的猜想。
(4)探究白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
CuCl中铜元素的化合价是________。
【查阅资料】
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu(NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
【进行实验】
①取烧杯底部的白色沉淀,充分洗涤;
②向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
③取其中一份无色溶液……
④将另一份无色溶液放置于空气中……
以上步骤③的实验方案是________;步骤④的现象是________。
【得出结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】Al和CuCl2溶液反应为什么会出现CuCl呢?
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15% CuCl2溶液混合,无白色沉淀产生。
(5)丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是________。
(6)丁同学认为丙同学的实验还不够严谨,还应考虑________对Cu与CuCl2溶液反应的影响。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定温度下,向烧杯中加入一定质量的水,仅有部分晶体溶解.所得溶液与原溶液相比,说法正确的是( )
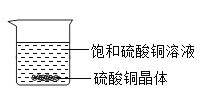
A.溶剂的质量增加,溶液颜色变浅 B.溶质溶解度不变,溶液颜色变深
C.溶质的质量增加,溶液颜色变深 D.溶质溶解度不变,溶液颜色不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入a克Zn粉,充分反应后过滤,将洗涤、干燥后称量,得到的固体质量为a克。据此,下列说法正确的是( )
A. 滤液中的物质一定至少有两种
B. 取反应后的滤液滴加稀盐酸,可能有白色沉淀产生
C. 取滤渣滴加稀盐酸,一定有气泡产生
D. 取反应后的滤液观察,滤液一定呈无色
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
(1)实验一:恒温条件下,向100mL一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
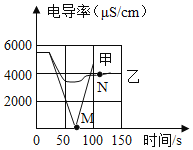
①甲曲线M点时混合液体呈_____色;
②通过对甲曲线的分析,下列说法错误的是_____(填序号).
a.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
b.M点时离子浓度几乎为零
c.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
③经测定,M点时消耗稀H2SO4溶液50mL,且过滤后滤液质量为147. 67g。请计算原Ba(OH)2溶液的溶质质量分数_____ (写出计算过程,各种稀溶液的密度都可看成1g·mL-1)。
(2)实验二:恒温条件下,向100mL同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是_____(填序号).
a.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
b.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
c.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是______________(填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度_____(填“增大”或“减小”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com