
����Ŀ���о���ѧϰС��ѡ��ӿ�������ȡ������Ϊ�о����⣬������������Ƶ�ʵ�鷽����
��1����ȥ������̼��ˮ��������ͼAװ���з�����Ӧ�Ļ�ѧ����ʽ�� �� Bװ����Ũ����������� �� 
��2����ȥ���������Ƿֱ��ռ�һƿ��������ͼװ�ý��г�ȥ������ȼ��ʵ�飬���м�ͬѧѡ�ú��ף���ͬѧѡ��ľ̿������Ϊ��ѡ��������ס���ľ̿�����ķ�������ѧ��ԭ���� �� 
��3���������˷��õ��ĵ����ܶȣ���״���£�����ѧ�ⶨ���뵪����ʵ���ܶ�������������������Ŀ���ԭ��ֻд���֣������Ǽ������� ����
�� ��
���𰸡�
��1��CO2+2NaOH=Na2CO3+H2O����ȥˮ����
��2��ľ̿��ľ̿ȼ�ղ���������̼���壬���µ�������
��3��ϡ������û�г�ȥ������û�г���
���������⣺Ҫ�ӿ�������ȡ�����������Ҫ�������е�������ϡ�����塢������̼��ˮ����������������������������ƿ��Գ�ȥ������̼��Ũ��������ˮ�ԣ����Գ�ȥˮ�������ú��׳�ȥ���������Dz���ѡ��ľ̿����������Ϊľ̿ȼ�ղ���������̼���壬���µ���������������ȡ�ĵ���������ϡ�����弰����������������û�г�����ʹ�����������ⶨ���ܶȲ�ȷ�����������������̼��ˮ����������Ҳ��Ӱ��ⶨ�Ľ���� �ʴ�Ϊ����1��CO2+2NaOH=Na2CO3+H2O����ȥˮ��������2��ľ̿��ľ̿ȼ�ղ���������̼���壬���µ�����������3����ϡ������û�г�ȥ��������û�г�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��С����������ʹ���ʯ��ȡ������̼ʱ�����ֲ������ݵ����ʲ�һ����ͬѧ��չ����̽������������Ũ��Ϊ10%��20%������ʯ��ϸ������ֿ������ֹ��ʵ���¶�Ϊ20�桢30�棬ÿ��ʵ�����������Ϊ100mL������ʯ����Ϊ10.0g��
��������⡿���������ʯ��Ӧ�Ŀ�������Щ���ص�Ӱ���أ�
����������衿a������������Ũ���йأ�b���������¶��йأ�c�����������ʯ����й�
��1������Ʋ�ʵ�顿
���������ʵ����Ʊ�������ʵ��Ŀ��һ������д��Ӧ��ʵ���ţ�
ʵ�� | �¶ȣ��棩 | ����ʯ | ����Ũ�ȣ���ȡ100mL�� | ʵ��Ŀ�� |
�� | 20 | �ֿ��� | 20% | ����ʵ��ٺ͢�̽������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 |
�� | 20 | �ֿ��� | 10% | |
�� | ϸ���� | 20% | ||
�� | �ֿ��� |
��д������ʯ�����ᷴӦ�Ļ�ѧ����ʽ
��2��������������ʵ�����CO2������ʱ��仯�Ĺ�ϵ��ͼ��
���������ݡ�
����ͼ�������������ߣ�����ʵ��۶�Ӧ������ΪB�����۩�B����д���ܷ�ӳ��������ʵ���Ӧ������ �� �� ��
��3������չ��
���Ϸ�����ͨ��������������������жϻ�ѧ��Ӧ�Ŀ����������Խ���������Ӧ�������жϷ�Ӧ�Ŀ���������Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�Ļ��������ǣ� ��
A.���µ���������
B.������ų�
C.���ȡ�����
D.����ɫ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��HCl��Cl2��HClO �е���Ԫ�ؾ�����ͬ�ģ� ��
A.���������
B.��ѧ����
C.�˵����
D.���ϼۼ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ֻ��ʢ��100mLˮ���ձ��У��ֱ������ͬ�����ļס����������ʣ�ʹ�����ܽ⣬�����ͼ��ʾ������˵����ȷ���ǣ� �� 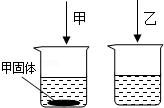
A.����Һ�Dz�������Һ
B.�����£��ס����������ʵ��ܽ����ͬ
C.�����¶ȣ�ʣ��ļ���һ���ܼ����ܽ�
D.����Һ�����DZ�����Һ��Ҳ�����Dz�������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KClO3��MnO2�Ļ����25g���ȵ����ٷų�����ʱ���õ�ʣ�����15.4g����Ӧ�����ɵ�����������Ϊ�� ��
A.9.6g
B.14.9g
C.0.5g
D.3.2g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������װ�ûش��й����⣮ 
��1��д��ͼ�д�������������ƣ� ��
��2��ʵ������A��C��D��E�����ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ �� ��Eװ���ռ�����ʱ�����ܷ��뼯��ƿ�ڵ�����ʱ���� ��
��3������װһ���ʺϹ����Һ�巴Ӧ���ܿ��Ʒ�Ӧ�Ŀ�ʼ��ֹͣ�ķ���װ�� ��
��4����ʹ��Fװ�ø��������̼���壬����Fװ���м��� �� ����Ӧ�����a����b�����ڽ��룮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г������������ڻ�ѧ�仯���ǣ� ��
A.��ѩ�ڻ�
B.���г���Ȧ����
C.���������ۻ�
D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˽����ķֽ���ʵ��С�����������̽���� ���������ϡ����ᣨHCOOH�����۵�Ϊ8.6�棬�ֽܷ������������ʣ�
��������롿ʵ��С��Լ���ķֽ��������˲��룺
����1��H2��CO2������2��CO��H2O��
��1�������ʵ�顿20��ʱ�������״̬Ϊ����ͼһװ����ѡ����ʵ�װ��������ţ��Լ�����м��ȣ�Ϊ�˼ӿ�ֽ����ʣ�ʵ��С������˴�������Ӧ�ֽ����ͨ��ͼ��װ�ý���ʵ�飮 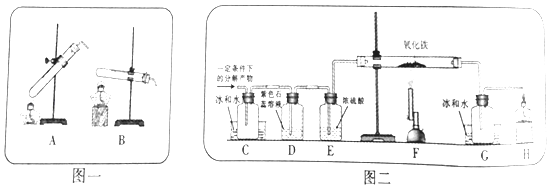
��2����ʵ��Ԥ�⡿������l��������D�е�ʵ������ӦΪ ��
��3��������ʵ�顿ʵ���й۲쵽C��ƿ�ڳ��ִ���ˮ�飬F���������г��ֵ�����Ϊ �� ����ֽ�Ļ�ѧ����ʽΪ ��
��4����������չ�����ϱ�������ͬ�����£�����ķֽ���ﲻͬ������1�Ͳ���2���ܳ������ݴ�С�¶Լ���ķֽ����������²��룺����3��H2O��CO2������4��CO��H2 �� ��������Ϊ�������ʵ�����ȷ������3�Ͳ���4������������ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com