
【题目】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等.其组成一般以xMgCO3yMg(OH)2zH2O表示. 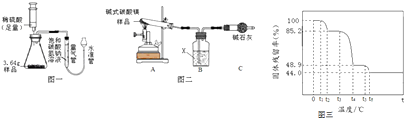
(1)研究其分解产物 (i)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是 .
(ii)检验生成物中是否含有碳酸镁、氢氧化镁.
操作现象 | 结论 | |
① | 取适量生成物置于试管中, . | 生成物中不含碳酸镁. |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液,观察到现象. | 生成物中不含氢氧化镁. |
(iii)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 . 综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 .
(2)测定碱式碳酸镁中碳元素的质量分数 按图一进行实验.
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为 , 若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将(填“偏大”、“偏小”或“无影响”).
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为 , 碳元素的质量分数为 . (实验条件下CO2密度为1.97g/L)
(3)确定碱式碳酸镁的组成 设计如图二装置,并按下述步骤操作.
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g.
步骤2:加热装置A直至样品完全反应.
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温.
步骤4:称量装置B的质量为199.2g.
(i)装置B中物质为 , 装置C的作用为 . 判断样品完全反应的方法:当观察到装置B中 , 则样品已完全反应.
(4)(ii)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程.
(5)有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗? 另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率( ![]() ×100%)随温度的变化如图三所示,请回答下列问题.
×100%)随温度的变化如图三所示,请回答下列问题.
①0至t1过程中固体质量保持不变的原因是 .
②分析图像数据判定该说法是(填“真的”或“假的”),判定理由是
【答案】
(1)镁是银白色的固体,碳是黑色的固体;加入盐酸,没有气泡产生;溶液不变色;氢氧化镁在冷水中很难溶解;氧化镁
(2)二氧化碳能溶于水;偏大;670mL;9.9%
(3)浓硫酸;吸收二氧化碳;无气体产生
(4)解:反应前B的质量是192g,反应后B的质量是199.2g,故生成水的质量为:199.2g﹣192g=7.2g
由图一实验得,加入3.64g样品得到的碳元素的质量为0.36g,图二的实验加入样品质量为36.4g,则碳元素的质量为3.6g,则MgCO3的个数为 ![]() =0.3
=0.3
根据反应式MgCO3 ![]() MgO+CO2↑得:
MgO+CO2↑得:
0.3MgCO3分解得到的MgO质量为40×0.3=12g,CO2的质量为0.3×44=13.2g;
根据反应式yMg(OH)2 ![]() yMgO+yH2O得:
yMgO+yH2O得:
yMg(OH)2分解得到的MgO的质量为40y,得到水的质量为18y;
所以产物MgO的总质量为12g+40y,CO2的总质量为13.2g,水的总质量为18y+18z=7.2g;
根据质量守恒定律得:12g+40y+13.2g+7.2g=36.4g
40y=4g
y=0.1
所以有:18×0.1+18z=7.2
z=0.3
因此x:y:z=0.3:0.1:0.3=3:1:3
该碱式碳酸镁的化学式为3MgCO3Mg(OH)23H2O
(5)温度没有达到碱石碳酸镁分解的温度;假的;若加热3.64g碱式碳酸镁温度从t3至t4段固体减少质量为3.64g×85.2%﹣3.64g×48.9%=1.32g与实验中生成二氧化碳质量相等
【解析】解:(1)(i)取样高温灼烧,由于镁是银白色的固体而碳是黑色的固体,故推断生成物中肯定不含金属镁及单质碳,故填:镁是银白色的固体而碳是黑色的固体.(ii)碳酸盐遇酸会产生二氧化碳气体,故可以加入盐酸确定是否含有碳酸镁;氢氧化镁溶于热水呈碱性,能使酚酞试液变红,故填:
操作现象 | 结论 | |
① | 取适量生成物置于试管中,加入盐酸,没有气泡产生. | 生成物中不含碳酸镁. |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液, | 生成物中不含氢氧化镁. |
(iii)固体物质的溶解度一般随温度的升高而增大,氢氧化镁在冷水中很难溶剂,故用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水;经过推断,碱式碳酸镁的分解产物为二氧化碳、水和氧化镁,故填:氢氧化镁在冷水中很难溶溶解;氧化镁.(2)①由于二氧化碳能溶于水,故量气管中装有饱和碳酸氢钠溶液不能用水代替;若用稀盐酸代替稀硫酸,则测出的二氧化碳的质量偏大,会导致测定的碳元素的质量分数偏大,故填:二氧化碳能溶于水;偏大;
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为: ![]() ≈0.670L=670mL,碳元素质量为:1.32g×
≈0.670L=670mL,碳元素质量为:1.32g× ![]() =0.36g;
=0.36g;
碳元素的质量分数为: ![]() ;
;
故填:670mL;9.9%;
·(3)确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作.
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g.
步骤2:加热装置A直至样品完全反应.
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温.
步骤4:称量装置B的质量为199.2g.(i)碱式碳酸镁受热分解生成氧化镁、水二氧化碳,故装置B中盛有浓硫酸,用于吸收水,装置C中的碱石灰用于吸收二氧化碳;若是完全反应,则装置B中不再产生气体;故填:浓硫酸;吸收二氧化碳;无气体产生;(4)(ii)反应前B的质量是192g,反应后B的质量是199.2g,故生成水的质量为:199.2g﹣192g=7.2g;
由图一实验得,加入3.64g样品得到的碳元素的质量为0.36g,图二的实验加入样品质量为36.4g,则碳元素的质量为3.6g,则MgCO3的个数为 ![]() =0.3
=0.3
根据反应式MgCO3 ![]() MgO+CO2↑得:
MgO+CO2↑得:
0.3MgCO3分解得到的MgO质量为40×0.3=12g,CO2的质量为0.3×44=13.2g;
根据反应式yMg(OH)2 ![]() yMgO+yH2O得:
yMgO+yH2O得:
yMg(OH)2分解得到的MgO的质量为40y,得到水的质量为18y;
所以产物MgO的总质量为12g+40y,CO2的总质量为13.2g,水的总质量为18y+18z=7.2g;
根据质量守恒定律得:12g+40y+13.2g+7.2g=36.4g
40y=4g
y=0.1
所以有:18×0.1+18z=7.2
z=0.3
因此x:y:z=0.3:0.1:0.3=3:1:3
该碱式碳酸镁的化学式为3MgCO3Mg(OH)23H2O
·(5)①0至t1过程中固体质量保持不变的原因是温度没有达到碱石碳酸镁分解的温度,故填:温度没有达到碱石碳酸镁分解的温度;
②若加热3.64g碱式碳酸镁温度从t3至t4段固体减少质量为3.64g×85.2%﹣3.64g×48.9%=1.32g与实验中生成二氧化碳质量相等(或若加热3.64g碱式碳酸镁温度从t5至t6段固体减少质量为3.64g×48.9%﹣3.64g×44.0%=0.18g与实验中生成二氧化碳质量不相等).所以该说法是假的.故填:假的;若加热3.64g碱式碳酸镁温度从t3至t4段固体减少质量为3.64g×85.2%﹣3.64g×48.9%=1.32g与实验中生成二氧化碳质量相等(或若加热3.64g碱式碳酸镁温度从t5至t6段固体减少质量为3.64g×48.9%﹣3.64g×44.0%=0.18g与实验中生成二氧化碳质量不相等).
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】化学在环境保护、资源核能源利用等方面起着重要的作用.下列说法不正确的是( )
A. 涂油和刷油漆能防止钢铁生锈
B. 使用可降解塑料可以减少“白色污染”
C. PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性
D. 目前计入空气污染指数的有害气体主要包括:SO2、CO、NO2、O2等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】区分下列各组物质,所用的试剂或方法正确的是
A. 高锰酸钾和氯酸钾——观察颜色 B. 硬水和软水——闻气味
C. 黄铜片和纯铜片——相互刻画 D. CO2和N2——燃着的木条
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具.
(1)用化学符号填空: ①碘原子②三个铁离子;
③两个三氧化硫分子; ④人体中含量最多的金属元素
(2)用字母序号填空:a.Ca(OH)2 b.H2 c.C6H12O6 d.KMnO4①可用于实验室制氧气的是; ②可用于改良酸性土壤的是;
③可用作清洁能源的是; ④医学上称为“低血糖”中的糖是;
(3)写出下列反应的化学方程式: ①烧碱在空气中变质; ②电解水
③工业炼铁原理; ④加热氯酸钾和二氧化锰的混合物 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气是一种宝贵的自然资源,下列有关空气中各成分的说法正确的是 ( )
A. 氧气的化学性质比较活泼,能够燃烧
B. 稀有气体都不能与其他物质发生化学反应
C. 二氧化碳在空气中含量增多会引起温室效应,属于空气污染物
D. 氮气的化学性质不活泼,可用于食品防腐
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用如图装置进行气体的制取实验,请回答下列问题: 
(1)写出标号a仪器的名称: .
(2)用氯酸钾制取氧气的化学方程式 , 选择④装置收集氧气,气体从(填字母)端进入.若改用排水法收集,实验结束后先撤导气管后熄灭酒精灯,目的是防止 .
(3)实验室用大理石和(填写药品名称)反应制取二氧化碳.与②相比,③作为发生装置的优点是 , 在装置④中盛放可用于干燥二氧化碳气体.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com