
科目: 来源: 题型:
【题目】某化学兴趣小组在老师指导下进行课外实验,利用如图装置来探究单质在空气中燃烧后氧气浓度的变化情况。

(提出问题)足量红磷在密闭的四颈平底烧瓶内燃烧熄灭后,容器中是否有氧气剩余?
(猜想假设)猜想①:有氧气剩余;猜想②:无氧气剩余。
(实验验证)该小组同学按图组装好实验装置,利用高气压传感器能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置氧气完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
(1)激光笔的作用是 ___________。
(2)红磷燃烧产物与瓶底热水反应生成磷酸(H3PO4)的化学方程式为_____。
(3)实验过程中,燃烧匙内的白磷先未燃着的原因是____________。
(实验结论)根据上述实验现象,得出结论如下:
(4)结论:猜想_________正确。
(拓展延伸)如图是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用氧气传感器测量容器内氧气浓度变化的曲线图。
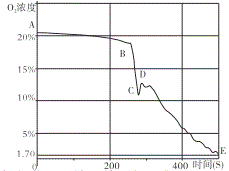
(5)在图中_____(填“A、B、C、D、E”)点时红磷燃烧熄灭;请你解释曲线AB段、DE段氧气浓度变化的主要原因:① _______。②________。
(6)小组同学通过查阅资料可知,验证空气中氧气体积分数较好的药品是铁丝绒,利用铁与氧气、水等的缓慢氧化,可以将空气中氧气浓度消耗至0.2%。将足量细铁丝绒置于试管底部,并倒扣在装有水的烧杯中(如图)较长时间后你将看到的现象是_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用____________的方法来降低水的硬度。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是_______(填序号)。
A.生理盐水 B.医用碘酒 C.高锰酸钾溶液 D.医用酒精
(3)下表是NaCl、KNO3在不同温度时的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(请用铅笔在答题卡的坐标纸上绘图)________
②根据绘制的氯化钠和硝酸钾的溶解度曲线判断,温度大约在_____℃时,两种物质的溶解度大小相等。
③现有氯化钠和硝酸钾各40g ,30℃时,分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是______(填溶质名称), 将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的方法是_____。
④在60℃时,硝酸钾的溶解度是110g。这句话的含义是______。
(4)以太阳能为热源,经由铁氧化合物循环分解水的过程如右图所示:
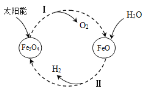
① 写出在一定条件下发生的反应Ⅱ的化学方程式______。
② 在上述循环过程中,最终得到的产品是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。
(1)硫酸铜、铁、过氧化氢三种物质中,由离子构成的是________。
(2) 如右图所示,向盛有红棕色二氧化氮气体的集气瓶里投入几小块烘烤过的木炭,
红棕色消失,说明木炭具有_____能力,其原因是木炭具有_____的结构。
(3)A、B、C、D表示四种物质,在高温条件下,A和B反应生成C和D,微观示意图如下所示。
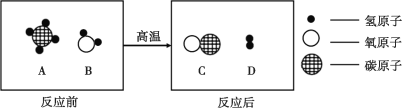
① 反应后,生成C和D两种粒子的个数比为______。
② 若有3 g D生成,参与反应的A质量为_______g。
③ 下列结论中,正确的是_______。
a.B和C属于氧化物 b.反应前后各元素化合价均发生改变
c.反应前后分子的个数没有改变 d.A物质中氢元素的质量分数为25%
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、生产密切相关。
(1)我国首架大型客机C919中使用了大量的铝镁合金,铝制品在空气中不易被腐蚀,具有“自我保护”能力,其原因是_____(用化学方程式表示)。
(2)铝、铜、银是日常生活中接触到的三种金属。同学甲设计了如下三个实验来验证它们的金属活动性强弱:① 铝、硝酸银溶液;②铜、硫酸铝溶液;③铜、硝酸银溶液。同学乙认为这一方案中实验 ______(填“①”、“②”、“③”)可以不做,也能验证三个金属的活动性强弱。请写出实验③中的实验现象______。
(3)中国南海海底有大量的可燃冰(CH4·nH2O)。
① 可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于________(选填“纯净物”或“混合物”)。
②甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | 未测 |
根据表格中数据,请完成甲烷在一定量的氧气中燃烧的化学方程式 _______。
(4)某工厂利用废硫酸与废铁屑反应制取硫酸亚铁。现制得FeSO4 1.52 t,需要铁的质量至少是多少?(在答题卡上写出计算过程)_______
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜渣中约含 Zn7%,ZnO 31%,Cu 50%,CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应) (查阅资料) ZnO+H2SO4=ZnSO4+H2O CuO+H2SO4=CuSO4+H2O 下列说法不正确的是
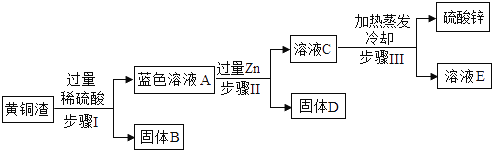
A. 步骤Ⅰ、步骤Ⅱ中的操作均包含过滤 B. 步骤Ⅰ、步骤Ⅱ过程中均有无色气泡生成
C. 固体B和固体D中均含有铜 D. 溶液 C中溶质至少还有2种
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是生活中常见的一种金属,在生活、生产中有广泛的应用。

(1)如图为铜元素在元素周期表中的信息,铜元素的原子序数为___;
(2)铜离子(Cu2+)的核外电子数为____________;
(3)电气工业上常用铜作电缆的内芯,是利用铜具有良好的_____性;
(4)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了“铜绿”(化学式:Cu2(OH)2CO3)。
某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图所示实验中的_____(选填实验编号甲、乙、丙、丁)
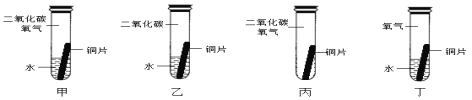
(5)某兴趣小组以锈蚀严重的废铜屑为原料(假设不含其他杂质)制取纯铜。如图是兴趣小组设计的两种回收铜的实验方案:
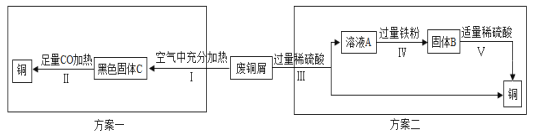
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
(分析评价)
①步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是___________;
②步骤Ⅳ过程发生反应的化学方程式为__________________、_________________;
③同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一_____(填“>”或“=”或“<”)方案二。以上两种方案中,方案二优越于方案一,理由是________(答一点)。
(拓展探究)在方案一中,小明和小丽分别取24克氧化铜,用CO还原,小明得到19.2克红色固体,小丽得到20.8克红色固体。为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu2O)
Ⅱ.Cu2O+H2SO4(稀)=Cu+CuSO4+H2O
他们分析推断:
④一致认为________(填“小明”或“小丽”)的产物中肯定含有Cu2O;
⑤用CO还原4克CuO得到红色固体a克,若红色固体为Cu和Cu2O的混合物,则a的取值范围为____________;
⑥可以用简单的实验验证红色固体中是否有Cu2O,请简述操作、现象及结论:_____。
(6)我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),现将30g稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定本次生成氢气的质量,实验数据见表。试求:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的质量(g) | 10 | 10 | 10 |
本次生成氢气的质量(g) | 0.04 | m | 0.02 |
①m=____________。
②此黄铜样品中铜的质量分数是多少_______?。
③稀盐酸的溶质质量分数是_______。
④在坐标系中画出生成氢气总质量与加入盐酸质量关系的图像。______
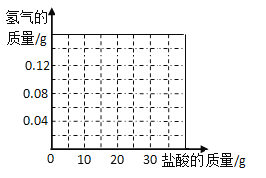
查看答案和解析>>
科目: 来源: 题型:
【题目】氧气、二氧化碳是我们身边常见的物质。某兴趣小组对这两种气体研究如下:
Ⅰ.氧气、二氧化碳的制备:
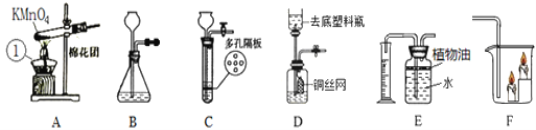
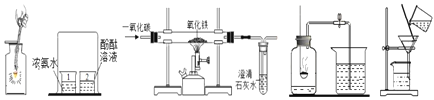
(1)写出A图中有标号仪器①的名称:__________。
(2)写出用KMnO4制取O2的化学方程式___________________,该装置中棉花团的作用是__________,图中装置一处明显的错误是__________。
(3)在化学实验室中用石灰石和稀盐酸来制取二氧化碳可选用图B所示的发生装置,该反应的化学方程式是__________。
(4)制二氧化碳也可选用如图C所示的装置,与B装置相比,C装置的优点是_________,用图D装置也可以制取二氧化碳,将石灰石放在铜丝网中,该实验说明了铜____(填“能”或“不能”)和稀盐酸发生反应。
Ⅱ.二氧化碳的性质及氧气的收集研究:
(1)二氧化碳的性质研究
①如图E所示的装置可以测定一段时间收集的二氧化碳的体积,植物油的作用是____。
②如图F所示的装置说明了二氧化碳具有__________的性质,该性质在实际生活中的应用是__________。
③已知:CO2和SO2既有相似性,又有差异性。
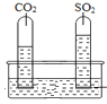
实验一:将收集满两种气体的试管同时倒立于盛水的水槽中,片刻后实验现象如图所示,说明相同条件下SO2比CO2__________(填“易”或“难”)溶于水。
实验二:已知镁条可以在CO2中剧列燃烧: 2Mg+CO2![]() 2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,__________。
2MgO+C,试推测镁条在SO2中燃烧的现象为:剧烈燃烧,__________。
(2)氧气的收集
(实验1)用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
(实验2)用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
(实验3)用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据①由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是__________。
②不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是初中化学中的一些重要实验。请回答:
A B C D E F
(1)A实验是铁丝在氧气中燃烧,可能导致的后果是________,改进措施是_____;
(2)B实验探究了分子的性质,一段时间后观察到的现象是_____,说明了______;
(3)C实验是一氧化碳还原氧化铁,实验开始时先__________后_________,硬质玻璃管中发生反应的化学方程式是__________,该装置的缺陷是____________;
(4)图D是利用红磷测定空气中氧气的含量实验,实验结束后,发现进入集气瓶中水的体积超过总容积的1/5,你认为导致这一结果的原因可能是__________(填序号)
a.实验前未将橡胶管夹紧 b.未等冷却就打开止水夹
c.实验前导管中未加满水 d.红磷的量不足
(5)C是过滤操作,其中玻璃棒的作用是___________,过滤后发现滤液仍然浑浊,其可能的原因是_____________(答出一种原因即可);
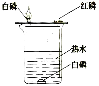
(6)F实验为探究燃烧的条件,其中热水的作用是____________、__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命之源,是自然界中重要的物质。
(1)如图是某矿泉水的标签中的一部分。

①请写出标签中符合下列要求的微粒的化学符号:
镁离子________ 硫酸根离子 _______
②该天然矿泉水产地儿童智力发育较好可能与矿泉水中的_____元素有关,它属于人体必需的____元素(填“微量”或“常量”)。
③该矿泉水为______(填“纯净物”或“混合物”)。
(2)自来水的生产过程如下左图:
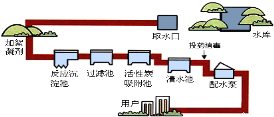
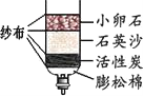
①生活中将硬水进行软化的方法是_____。
②“投药消毒”这一步是______ 变化(填“物理”“化学”)。
③自制净化器(见右图)中用到活性炭,主要是利用其_______性,石英沙和小卵石的作用是________。
(3)电解水的图示如下:
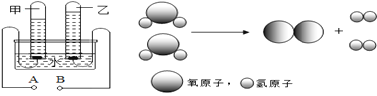
电解水通常用直流电,图中正极是____ 端(填“A”、“B”), 甲管中气体具有__ (填“可燃性”“助燃性”);在90g水中加入4g氢氧化钠(NaOH)的作用是_______,电解前溶液中氢元素的质量为_______g,电解后溶液中氢氧化钠的质量分数_______(填“变大”、“变小”或“不变”)。写出电解水的化学方程式____________ ,能够保持氧气化学性质的最小微粒是下列中的 ________ (填字母)。
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳”是实现“人类命运共同体”的重要方面。以下流程是通过控制化学反应的条件来促进或抑制化学反应,实现“低碳”,从而更好地通过化学反应为人类造福。从图中分析得出的下列结论中,正确的是
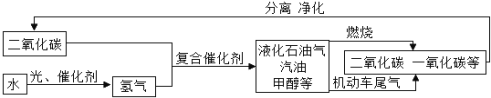
A. 水转变成氢气的过程实现了光能转变为化学能
B. 二氧化碳与氢气在复合催化剂的作用下的反应产物是混合物
C. 二氧化碳不是一种重要的资源
D. 上述流程可循环利用的物质是二氧化碳、一氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com