
【题目】某课外活动小组如图所示进行了乙醇的催化氧化实验,试管A中盛有无水乙醇,B中装有Cu或CuO(用石棉绒作载体),C中装的是澄清石灰水。请回答下列问题:

(1)向试管A中鼓入空气的目的是:___。
(2)烧杯中水的作用是:___。
(3)玻璃管B中观察到的现象固体由黑变红,原因是(请用化学方程式解释):___。
(4)在实验过程中,试管C的导管口有气泡冒出,从液面逸出的气体的主要成分是___,实验后在试管C的溶液中加入新制Cu(OH)2悬浊液,加热,现象是:___。
(5)写出乙醇发生催化氧化的化学反应方程式:___。
【答案】使空气通过乙醇,形成乙醇和空气的混合气体 使试管受热均匀,便于控制温度 CuO+C2H5OH![]() CH3CHO+H2O+Cu N2 有红色沉淀产生 2CH2CH2OH+O2
CH3CHO+H2O+Cu N2 有红色沉淀产生 2CH2CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
A装置提供乙醇气体和空气,B装置发生乙醇的催化氧化,C装置吸收产物,结合物质的性质分析解答。
(1)A中通入空气的目的是提供氧化乙醇的氧化剂氧气并形成乙醇和空气的混合气体;
(2)水的沸点是100℃,用水浴加热,使反应容器内试剂受热温度均匀,便于控制温度;
(3)乙醇和氧化铜在加热条件下发生氧化还原反应,-CH2OH结构被氧化为-CHO结构,生成乙醛,反应的方程式为CuO+C2H5OH![]() CH3CHO+H2O+Cu;
CH3CHO+H2O+Cu;
(4)氧气和乙醇发生氧化还原反应,最终气体含有乙醇、乙醛和氮气,由于乙醇、乙醛易溶于水,则最终气体为氮气,试管C的溶液主要成分为乙醛,乙醛和新制的Cu(OH)2悬浊液反应生成乙酸、氧化亚铜和水,所以观察到有砖红的沉淀产生;
(5)根据实验现象可以得出乙醇与氧气在铜做催化剂的条件下生成乙醛和水,化学方程式是2CH2CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJmol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJmol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJmol﹣1
常温下,取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿佛加德罗常数为NA,下列叙述正确的是
A.1molD2O所含质子数为12NA;B.1molNa2O2与足量水反应转移电子数为2NA;
C.10g 氖气所含原子数为0.5NA;D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如图:
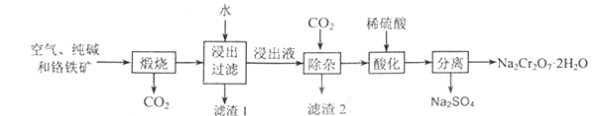
(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为:____。
(2)滤渣1的成分为_____,滤渣2的成分为_____。
(3)该工艺中某种产物可以再利用,该物质的化学式为:_____。
(4)酸化时发生的反应为:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有![]() 转化为Cr2O72-。
转化为Cr2O72-。
①酸化时发生反应的平衡常数的表达式为K=_____。
②酸化后所得溶液中c(Cr2O72-)=____。
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于____mol·L-1,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是____。
(2)汽车内燃机工作时发生的反应为N2(g)+O2(g)![]() 2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
(3)汽车尾气中也含有CO,已知CO能发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。
CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①向某容器中充入1.0molH2O(g)和1.0molCO(g),在一定条件下发生上述反应。混合气体中CO的物质的量(mol)与时间关系如下表所示:
0 | 5min | 10min | 15min | 20min | 25min | |
Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
Ⅱ(800℃) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验Ⅰ,实验Ⅱ改变的条件可能是_____。
②若开始时向绝热容器中投入一定量二氧化碳、氢气,在一定条件下发生上述可逆反应。下列图像正确且能说明可逆反应已达到平衡状态的是_____(填字母)。
A.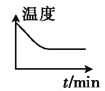 B.
B. C.
C.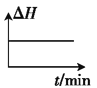 D.
D.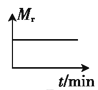
(4)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的产物中还有两种强酸生成,其中硝酸与NO2的物质的量相等,则其化学方程式是___。若有标准状况下11.2LN2生成,共消耗ClO2___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应5H2O + 3BrF3 = Br2 + O2↑+ HBrO3 + 9HF中,当有45克水被氧化时,被水还原的BrF3的物质的量是( )
A. 5/3 mol B. 5/2 mol C. 3/2 mol D. 4/3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,原子最外层电子数之和为17。其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
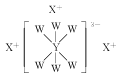
A.原子半径:Z>Y>X>W
B.X与Z形成的化合物会抑制水的电离
C.X、Z均能形成两种常见氧化物
D.W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com