
【题目】Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第____周期第____族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
【答案】三 ![]() 2 1s2s22p63s23p2 < > < <
2 1s2s22p63s23p2 < > < <
【解析】
第一电离能反应的是基态原子失去第一个电子需要的能量,越低即越容易失去;电子排布相同的两种离子,原子序数越小则半径越大;而一般来讲,原子晶体的熔沸点高于离子晶体,离子晶体的熔沸点高于分子晶体,最后是酸性比较,对于最高价氧化物对应的水化物来说,中心原子的非金属性越强,则酸性越强,据此来填空即可。
(1)钠位于元素周期表的第三周期第![]() 族;硫原子的电子排布式为
族;硫原子的电子排布式为![]() ,其p轨道上有2个未成对电子;而硅是14号元素,其电子排布式为
,其p轨道上有2个未成对电子;而硅是14号元素,其电子排布式为![]() ;
;
(2)硅的非金属性弱于硫,换句话说就是硅的金属性强于硫,因此硅更容易失去第一个电子,其第一电离能小于硫;氧的原子序数小于钠,因此![]() 的半径大于
的半径大于![]() ,氯化钠属于离子晶体,单质硅属于原子晶体,原子晶体的熔沸点一般高于离子晶体;硫的非金属性弱于氯,因此高氯酸的酸性强于硫酸。
,氯化钠属于离子晶体,单质硅属于原子晶体,原子晶体的熔沸点一般高于离子晶体;硫的非金属性弱于氯,因此高氯酸的酸性强于硫酸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
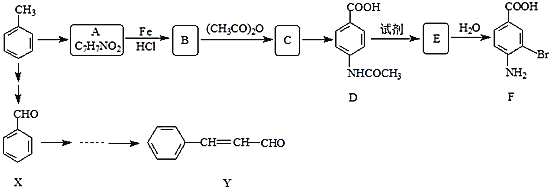
已知:Ⅰ.![]()
![]()
![]()
Ⅱ.2CH3CHO![]()
![]()
Ⅲ.—NH2易被强氧化剂氧化
请回答下列问题:
![]() 写出Y中官能团的名称______;
写出Y中官能团的名称______;
![]() 写出由甲苯
写出由甲苯![]() 反应的化学方程式:______;
反应的化学方程式:______;
![]() 在合成F的过程中,
在合成F的过程中,![]() 步骤不能省略,理由是______,F在一定条件下形成的高分子化合物的结构简式是______;
步骤不能省略,理由是______,F在一定条件下形成的高分子化合物的结构简式是______;
![]() 写出同时符合下列条件的Y的同分异构体的结构简式______;
写出同时符合下列条件的Y的同分异构体的结构简式______;
![]() 苯环上只有两种不同化学环境的氢原子
苯环上只有两种不同化学环境的氢原子
![]() 与
与![]() 溶液反应显紫色
溶液反应显紫色
![]() 分子中只存在一个环状结构
分子中只存在一个环状结构
![]() 结合本题信息和所学知识,以X和乙烯为原料可合成Y,请写出你设计的合成路线______
结合本题信息和所学知识,以X和乙烯为原料可合成Y,请写出你设计的合成路线______![]() 无机试剂及溶剂任选
无机试剂及溶剂任选![]() 。合成路线的书写格式如下:
。合成路线的书写格式如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为__________________。
②BH4-的空间构型是________________(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3实现储氢和输氢。
2NH3实现储氢和输氢。
①上述方程式涉及的三种气体熔点由低到高的顺序是__________________。
②下列说法正确的是________(填字母)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+中,N原子是配位原子
d.CN-的电子式为![]()
(3)Ca与C60生成的Ca32C60能大量吸附H2分子。
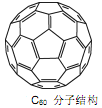
①C60晶体易溶于苯、CS2,说明C60是________分子(填“极性”或“非极性”);
②1个C60分子中,含有σ键数目为________个。
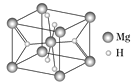
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为____cm3[用a、NA表示(NA表示阿伏加德罗常数)]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g) + 3Y(g)![]() 2Z(g) ΔH < 0。图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所变化,但都没有改变各物质的初始加入量。下列说法正确的是( )
2Z(g) ΔH < 0。图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所变化,但都没有改变各物质的初始加入量。下列说法正确的是( )
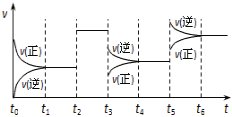
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间内反应物转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中![]() 与温度
与温度![]() 的关系曲线如图。下列说法正确的是
的关系曲线如图。下列说法正确的是
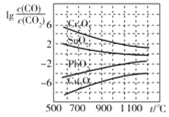
A.通过增高反应炉的高度,增大矿石和CO接触面积,能减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属Cr
C.CO还原![]() 的反应
的反应![]()
D.工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M能层上有________个能级,有________个轨道,作为内层最多可容纳________个电子,作为最外层时,最多可含有________个未成对电子。
(2)E原子核外电子占有9个轨道,且具有1个未成对电子,E离子结构示意图是____________。
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是________,F2-的电子排布式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,各物质之间的转化关系如图所示![]() 部分反应条件略去
部分反应条件略去![]() .
.

![]() 若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
![]() 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
![]() 若组成A的元素在短周期中原子半径最大
若组成A的元素在短周期中原子半径最大![]() 稀有气体除外
稀有气体除外![]() ,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______
,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______ ![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
![]() 的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
![]() 将
将![]() 的X溶液与
的X溶液与![]() 的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),有关化学键的键能数据如表所示:
Si(s)+4HCl(g),有关化学键的键能数据如表所示:
化学键 | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能kJ/mol | 360 | 436 | 431 | 176 | 347 |
下列说法正确的是( )
A.反应中的能量变化与物质的状态无关
B.像这样需要加热才能进行的反应都是吸热反应
C.晶体硅比SiC更稳定
D.该反应中每生成1molSi(s)吸收的能量为236kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(l)食品和药物安全是国家高度重视的民生问题。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______;
②是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______;
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______。
(2)钢铁是目前用量最大、用途最广的合金材料,在潮湿空气中容易发生腐蚀。请写出钢铁发生电化学腐蚀的负极反应式_______________________________________。
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料, 生活中的玻璃、陶瓷、水泥属于上述材料中的______________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com