
【题目】下列离子方程式能正确描述实验事实的是( )
A. 镁粉加到氯水中,氯水褪色:![]()
B. 双氧水和稀硫酸同时加到84消毒液中,产生大量气泡:![]()
C. ![]() 混和溶液中产生淡黄色沉淀:
混和溶液中产生淡黄色沉淀:![]()
D. 在![]() 溶液中通入
溶液中通入![]() 气,溶液颜色变深:
气,溶液颜色变深:![]()
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是

A.Y单质的熔点高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.Z元素在自然界中既有游离态也有化合态
D.1moIW 和X形成的化合物中可能含有4mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的______。(填序号)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
(2)下列可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是______。(填序号)
2HI(g)已达平衡状态的是______。(填序号)
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内气体颜色不再变化
⑨条件一定,混合气体的平均相对分子质量不再变化
(3)已知下列反应的平衡常数:①H2(g)+S(s) ![]() H2S(g),K1;
H2S(g),K1;
②S(s)+O2(g) ![]() SO2(g),K2;则反应H2(g)+SO2(g)
SO2(g),K2;则反应H2(g)+SO2(g) ![]() O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
(4)已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
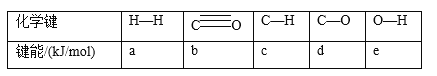
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
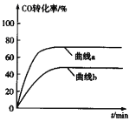
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
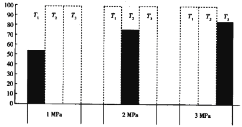
T1、T2、T3由大到小的关系是_________,判断理由是____________
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
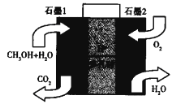
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的化工产品,它在纺织、印染、医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
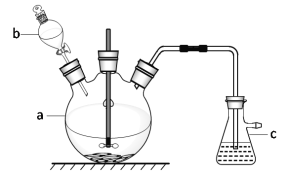
①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热。
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为_______;将仪器b中液体滴入仪器a中的具体操作是_____________。
(2)写出仪器a中反应的化学方程式:________________。
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是____________________。
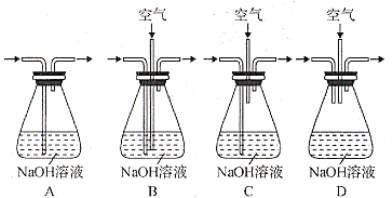
(4)为提高尾气吸收,防止空气污染,下列装置___________(填字母)适合吸收逸出的气体(反应中产生的气体因来不及被石灰乳吸收而逸出)。
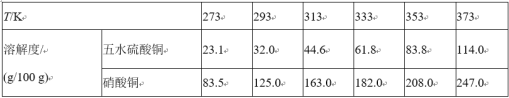
(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:_________。除去硫酸铜晶体中的少量硝酸铜可采用____________方法,检验硝酸铜是否被除净的方法:_____________。
(6)本实验采用硝酸氧化法制取硫酸铜,工业上也常采用将铜在450 ℃左右焙烧,再与一定浓度的硫酸反应制取硫酸铜的方法。采用硝酸氧化法的优点在于__________________。
(7)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成 100 mL 溶液,每次取 20. 00 mL,用 c mol L-1 EDTA (H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。 滴定反应为Cu2++ H2Y2-→CuY2-+2H+。计算蓝色晶体中Cu2+质量分数w=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A.铝制餐具不宜长期存放酸性食物:2Al+6H+=2Al3++3H2↑
B.用NaHCO3溶液除去CO2中的HCl气体:HCO3-+H+=CO2↑ +H2O
C.口罩中无纺布纤维聚丙烯的合成:nCH3CH=CH2![]()
![]()
D.硬塑料中酚醛树脂的合成: 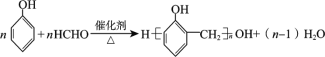
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 以
以![]() (体积比)分别通入到体积为2L的恒容密闭容器中进行反应:
(体积比)分别通入到体积为2L的恒容密闭容器中进行反应:![]() ,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
实验 | 温度/℃ | 起始 | 平衡 | 达平衡所需时间/min |
① | 500 | 5.00 | 2.00 | 40 |
② | 800 | 3.00 | 1.00 | 15 |
③ | 500 | 3.00 | 1.20 | 9 |
A. 实验①中,在![]() 内,以
内,以![]() 表示的反应速率大于
表示的反应速率大于![]()
B. 比较实验①和②,不能说明浓度对反应速率的影响
C. 比较实验①和②,不能说明反应速率随温度升高而增大
D. 比较实验②和③,说明实验③使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某热再生电池工作原理如下图所示。通入![]() 时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:
时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
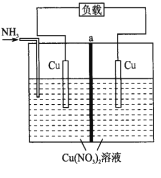
A. 此电池为二次电池
B. 放电时,左边电极发生氧化反应
C. a为阳离子交换膜
D. 放电时,转移![]() 电子,两电极质量变化的差值为
电子,两电极质量变化的差值为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是

A.该装置可以将光能转化为电能,同时也能转化为化学能
B.TiO2电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com