
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
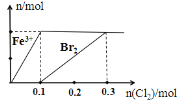
A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2) =0. 12 mol时,溶液中的离子浓度有:c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2) =1∶1时,反应的离子方程式为:2Fe2++2Br-+ 2Cl2=2Fe3++Br2 + 4Cl-
【答案】C
【解析】
A.由图可知,氯气先氧化亚铁离子,后氧化溴离子,则还原性:Fe2+<Br-,则氧化性强弱:Br2>Fe3+,故A正确;
B.图中通入0.1mol氯气时亚铁离子完全被氧化生成0.2molFe3+,由Fe原子守恒及c=![]() 可知该FeBr2溶液的浓度为
可知该FeBr2溶液的浓度为![]() =1molL1,故B正确;
=1molL1,故B正确;
C.n(Cl2)=0.12mol时,0.1mol氯气时亚铁离子完全被氧化生成0.2molFe3+,由2Br-+Cl2=2Cl-+Br2可知,0.02molCl2氧化0.04molBr-,溶液中的离子浓度有c(Fe3+):c(Br-)=0.2mol:(0.4mol-0.04mol)=5:9,故C错误;
D.n(FeBr2):n(Cl2)=1:1时,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化,则反应的离子方程式为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D正确;
答案选C。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝不滴落下来 | 氧化铝的熔点高于铝的熔点 |
C | 常温下,用pH计测0.1mol/LNaX溶液和0.1mol/LNa2CO3溶液的pH | 前者小于后者 | 酸性:HX>H2CO3 |
D | 向10%的蔗糖溶液中加入少量稀硫酸,水浴加热一段时间,再加入银氨溶液 | 未出现光亮银镜 | 蔗糖未发生水解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R—C≡C—H![]() R—C≡C—C≡C—R+H2该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R—C≡C—C≡C—R+H2该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
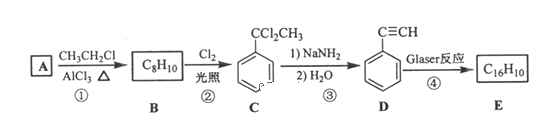
回答下列问题:
(1)B的结构简式为___,D的化学名称为___。
(2)①和③的反应类型分别为___、___。
(3)E的结构简式为___。用1molE合成1,4二苯基丁烷,理论上需要消耗氢气___mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为___。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为___。
(5)假设(4)生成1mol单一聚合度的G,若生成的G的总质量为1260g,则G的n值理论上应等于___。
(6)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式___。
(7)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,容积2L的密闭容器中,将2molL气体和3molM气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算:
(1)10s末L的物质的量浓度为_________。
(2)前10s内用M表示的化学反应速率为_________。
(3)化学方程式中x值为_________。
(4)L的转化率是_________。
(5)下列还可以说明该反应已达平衡的是_________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(M)=2v逆(R)
⑤n(L)∶n(M)∶n(R)=2∶3∶3
(6)在其它条件不变时,减小压强,化学反应反应速率_________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。下列有关说法正确的是:

A. 根据上述步骤II可以得出m(Fe2O3)∶m(Cu)=1∶1
B. 步骤I中减少的3 g固体一定是混合物
C. 步骤II中质量减少的物质一定是Cu
D. 根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
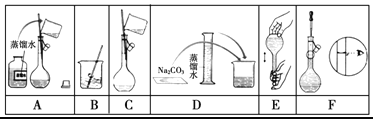
配制过程的先后顺序为(用字母A~F填写)________________。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将________(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将_______(填“偏高”、“偏低”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S4N4的结构如图:
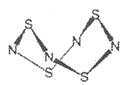
(1)S4N4的晶体类型是__。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是__。
a.离子键 b.极性键 c.非极性键 d.金属键 e.配位键 f.范德华力
②S2Cl2中,S原子轨道的杂化类型是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:

(1)若X是强氧化性单质,则A不可能是____。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为____。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____;C溶液在贮存时应加入少量X,理由是(离子方程式表示)___,检验此C溶液中金属元素价态的操作方法是____。
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为____,X的化学式可能为(写出不同类物质)____或____,反应②的离子方程式为___或___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A物质在一定条件下可转化为其它物质,已知A分子中所有碳原子不在同一条直线上,根据图示填空:
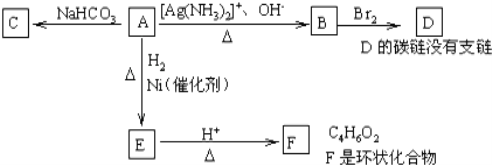
(1)化合物A含有的官能团名称是__。
(2)A转化为E的化学方程式是___。
(3)与A具有相同官能团的A的同分异构体的结构简式是__。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是__。
(5)F的结构简式是__,由E生成F的反应类型是__,由B生成D的反应类型是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com