
【题目】常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的的c(H+)与NaOH溶液的体积之间的关系如图所示,下列推断正确的是( )
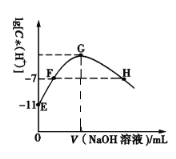
A. 可用pH试纸测定E点对应溶液,其pH=3
B. G点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
C. H、 F点对应溶液中都存在:c(Na+)=c(Cl-)+c(ClO-)
D. 常温下加水稀释H点对应溶液,溶液的pH增大
【答案】B
【解析】
A.E点新制氯水溶液,溶液显酸性,由水电离出的c水(H+)=10-11mo/L,溶液中OH-完全是由水电离出来的,所以c(OH-)=c水(H+)=10-11mo/L,则溶液中c(H+)=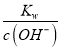 =10-3mol/L,则溶液pH=3,但新制氯水有漂白性,不能用pH试纸测量其pH,应该用pH计,选项A错误;
=10-3mol/L,则溶液pH=3,但新制氯水有漂白性,不能用pH试纸测量其pH,应该用pH计,选项A错误;
B.G点,氯水与氢氧化钠溶液恰好完全反应生成等物质的量的NaCl、NaClO,ClO-水解使溶液呈弱碱性,所以有c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),选项B正确;
C.F点对应溶液中溶质为NaCl、NaClO和NaOH,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),此时溶液为碱性,则c(OH-)>c(H+),所以c(Na+)>c(Cl-)+c(ClO-),选项C错误;
D.加水稀释H点对应的溶液,H点为碱性溶液,加水稀释时促使溶液的碱性减弱,所以pH值降低,选项D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化后逐一沉淀出来,其中B3+转入白色沉淀:
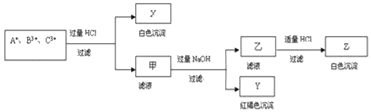
请通过分析回答(用化学符号填写):
(1)A+是__,B3+是__,C3+是__;
(2)X是__,Y是__,Z是__;
(3)写出下列离子方程式:
①生成Y沉淀:__;②B3+与过量氨水反应:__;
(4)写出下列化学方程式:单质铝和Y分解后的固体产物反应:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol/L KCl溶液,振荡 | |
实验④:滴加4滴1 mol/L KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡 |
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L 、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )
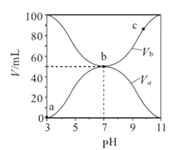
A. Ka(HA)的值与Kb(BOH)的值不相等
B. b点时,水电离出的c(H+)=10-7 mol/L
C. c点时,c(A-)>c(B+)
D. a→c过程中 ![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是一种重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:
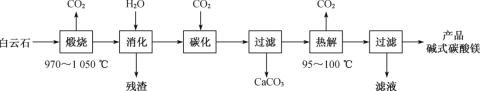
(1)“煅烧”时发生主要反应的化学方程式为___。
(2)常温常压下,“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
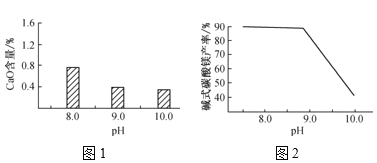
①应控制“碳化”终点pH约为___,钙元素的主要存在形式是___(填化学式)。
②根据图2,当pH=10.0时,镁元素的主要存在形式是___(填化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为___。
(4)该工艺为达到清洁生产,可以循环利用的物质是___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2600kJ
②2C6H6(g)+15O2(g)→12CO2(g)+6H2O(l)+6590kJ
下列说法正确的是
A.2mol C2H2(g) 完全燃烧生成气态水时放热大于2600kJ
B.2mol C6H6(l) 完全燃烧生成液态水时放热大于6590kJ
C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g) 三聚生成C6H6(g) 的过程属于放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com