
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10-2;Ka2=6.2×10-8 |
(1) 25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,三种溶液的pH由大到小的顺序为 _______________
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的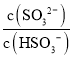 =___________
=___________
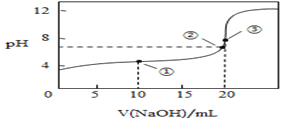
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:
①在滴定的实验过程中,不需要的仪器或用品是________(填序号)
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:___________________________
③下列操作会导致测定结果偏高的是 _________________
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)__________c(CH3COOH)+c(H+)(填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______/span>mol/L,此时溶液中c(CrO42-)等于_________mol/L(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
【答案】Na2CO3>Na2SO3>CH3COONa 0.62 ![]() 当滴入最后一滴标准液时,溶液由无色变为浅红色,且半分钟不褪色 AD
当滴入最后一滴标准液时,溶液由无色变为浅红色,且半分钟不褪色 AD ![]()
![]() c(Na+)>c(CH3COO-)> c(OH-)>c(H+) 2.0×10-5 5.0×10-3
c(Na+)>c(CH3COO-)> c(OH-)>c(H+) 2.0×10-5 5.0×10-3
【解析】
(1)酸的电离平衡常数越大,其对应的酸根离子水解程度越小,等浓度的钠盐溶液的pH越小;
(2)根据H2SO3的电离平衡常数Ka2,结合溶液中c(H+)=c(OH-)=10-7mol/L计算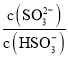 ;
;
(3)①根据酸碱中和滴定使用的仪器分析判断;
②用碱滴定酸,使用酚酞为指示剂,根据指示剂与溶液pH关系判断滴定现象;
③根据c(待测)=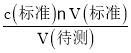 分析滴定误差;
分析滴定误差;
④点①所示溶液中,为等量的醋酸和醋酸钠溶液;点②所示溶液中,NaOH的体积小于20mL,为醋酸和醋酸钠溶液;点③所示溶液,恰好反应生成醋酸钠;
(4)根据溶度积常数计算溶液中c(CrO42-)的大小。
![]() 根据题目中所给平衡常数,可知酸性:CH3COOH>HSO3->HCO3-,所以水解程度:CH3COO-<SO32-<CO32-,因此等浓度的Na2CO3溶液、Na2SO3溶液、CH3COONa溶液pH由大到小的顺序为:Na2CO3>Na2SO3>CH3COONa;
根据题目中所给平衡常数,可知酸性:CH3COOH>HSO3->HCO3-,所以水解程度:CH3COO-<SO32-<CO32-,因此等浓度的Na2CO3溶液、Na2SO3溶液、CH3COONa溶液pH由大到小的顺序为:Na2CO3>Na2SO3>CH3COONa;
(2)根据H2SO3的Ka2=6.2×10-8可知,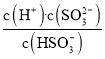 =6.2×10-8,当c(OH-)=降至10-7mol/L时,c(H+)=c(OH-)=10-7mol/L,溶液中的
=6.2×10-8,当c(OH-)=降至10-7mol/L时,c(H+)=c(OH-)=10-7mol/L,溶液中的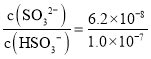 =0.62;
=0.62;
(3)①在整个滴定实验过程中,需要用到的主要仪器为滴定管、锥形瓶、滴定管夹、铁架台,不需要的仪器为100mL容量瓶、漏斗和玻璃棒,合理选项是ade;
②氢氧化钠与醋酸恰好反应时生成醋酸钠,醋酸钠水解使溶液呈碱性,要以酚酞为指示剂时,开始时溶液显无色,当恰好到达滴定终点的现象为:当滴入最后一滴NaOH标准液时,溶液由无色变为浅红色,且半分钟不褪色;
③A.碱式滴定管在装液前未用标准NaOH溶液润洗,将会导致标准液的浓度偏小,消耗标准液的体积偏大,导致实验结果偏高,A正确;
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出,将会使消耗标准液的体积偏小,最终导致实验结果偏小,B错误;
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡,将会导致消耗标准液的体积偏小,使实验结果偏小,C错误;
D.达到滴定终点时,仰视读数将会导致消耗标准液的体积偏大,使实验结果偏高,D正确;
故合理选项是AD;
④点①时溶液中的溶质为醋酸和醋酸钠,物质的量关系为1:1,电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),物料守恒为2c(Na+)=c(CH3COO-)+c(CH3COOH),则c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)。由于醋酸电离作用大于醋酸钠的水解作用,溶液呈酸性,c(H+)>c(OH-),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+);
点②所示溶液中,NaOH的体积小于20mL,为醋酸和醋酸钠溶液,根据物料守恒可知c(Na+)<c(CH3COO-)+c(CH3COOH);
点③所示溶液中为醋酸钠溶液,CH3COO-发生水解反应,消耗水电离产生的H+,最终达到平衡时溶液中c(H+)<c(OH-),溶液呈碱性,c(Na+)>c(CH3COO-),盐电离产生的离子浓度大于水电离产生的离子浓度,所以所有离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)> c(OH-)>c(H+);
(4)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10![]() mol/L=2.0×10-5mol/L,则此时溶液中c(Cr
mol/L=2.0×10-5mol/L,则此时溶液中c(Cr![]() )=
)=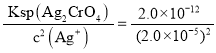 =5.0×10-3mol/L。
=5.0×10-3mol/L。


科目:高中化学 来源: 题型:
【题目】2009年我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。
(1)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是___。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(2)BeCl2熔点较低,易升华,其化学性质与AlCl3相似,可推测BeCl2熔融态___(选填“导电”或“不导电”),请写出BeCl2水解的化学方程式___。
(3)铝及其化合物在日常生活、工业上有广泛的应用。国产C919飞机外壳应用了铝合金材料。下列铝合金的性质与其用于飞机外壳无关的是(_______)
a.密度小 b.能导电 c.抗腐蚀性能强 d.硬度大
(4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是___。
a.Al2O3、MgO和SiO2都不溶于水 b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物 d.Al2O3、MgO和SiO2都有很高的熔点
(5)明矾可作净水剂。明矾(KAl(SO4)2·12H2O)的水溶液呈___性(选填“酸”、“碱”或“中”),写出明矾在水溶液中的电离反应方程式___;溶液中离子浓度大小顺序为___。
(6)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因___(用方程式说明);写出Al(OH)3的电离方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如下图所示),下列说法正确的是

A.分子A中所有碳原子均位于同一平面
B.用FeCl3溶液可检验物质B中是否混有A
C.物质B既能发生银镜反应,又能发生水解反应
D.1mol B最多可与5mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.100 mol·L-1的NaOH溶液分别逐滴加入到20.00 mL 0.100 0 mol·L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图。下列说法正确的是( )
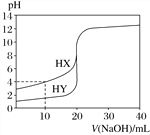
A. V(NaOH)=10.00 mL时,两份溶液中c(X-)>c(Y-)
B. V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C. V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-)
D. pH=7时,两份溶液中c(X-)=c(Na+)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在温度T1和T2时水的电离平衡曲线如图所示,下列说法错误的是
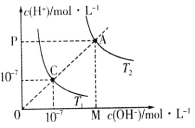
A.图中矩形OMAP的面积可以表示T2时水的离子积的值
B.水的离子积常数关系为:C > A
C.升高温度可实现由C点到A点
D.T1时,pH=4的硫酸与pH=l0的氢氧化钠溶液等体积混合,所得溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是( )
A.![]() 苯环上的一氯取代物有5种
苯环上的一氯取代物有5种
B.丁烷(C4H10)的二氯取代物最多有4种
C.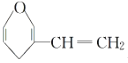 和
和 互为同分异构体
互为同分异构体
D.菲的结构简式为![]() ,其一硝基取代物有10种
,其一硝基取代物有10种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为氯气与金属钠反应设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
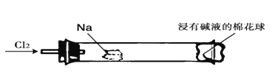
A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com