
【题目】为了测定含氰废水中CN-的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100 mL含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应后,打开活塞b,滴入稀硫酸,然后关闭活塞b。
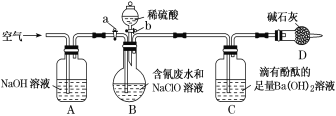
已知B中发生反应:CN-+ClO-===CNO-+Cl-、2CNO-+2H++3ClO-==N2↑+2CO2↑+3Cl-+H2O;
(1)装置D的作用是____。
(2)反应过程中,装置C中的实验现象为_____。
(3)待装置B中反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是____。
(4)反应结束后,装置C中生成59.1mg沉淀,则废水中c(CN-)=___mol·L-1。
【答案】防止空气中的CO2进入装置C 有白色沉淀生成,溶液的红色逐渐褪去 将反应产生的CO2全部排入装置C并被Ba(OH)2溶液完全吸收 0.003
【解析】
(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定C装置的质量的变化测得二氧化碳的质量,据此分析解答;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,据此分析解答;
(3)反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O,结合定量关系计算。
(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,故答案为:防止空气中的CO2和水蒸气进入C装置;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,故答案为:有白色沉淀生成,溶液的红色逐渐褪色;
(3)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置C并被Ba(OH)2完全吸收,以减少实验误差,故答案为:将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成沉淀为BaCO3↓物质的量=![]() =3×10-4mol,根据CN-~CNO-~CO2~BaCO3↓,可知c(CN-)=
=3×10-4mol,根据CN-~CNO-~CO2~BaCO3↓,可知c(CN-)=![]() =0.003mol/L,故答案为:0.003。
=0.003mol/L,故答案为:0.003。


科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
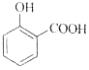 +2HCO3-→
+2HCO3-→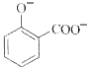 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法正确的( )
A. 常温常压下,22.4L的O2含有分子数为NA
B. 标准状况下,22.4L的SO3含有分子数为NA
C. 标准状况下,17gNH3含有的电子数为8 NA
D. 常温常压下,14gC2H4和C3H6的混合物含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是
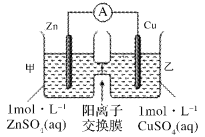
A. 该装置中电子的流动方向为:铜电极→锌电极
B. 电池工作一段时间后,甲池溶液的总质量不变
C. 电池工作一段时间后,乙池的c(SO42-)不变
D. 溶液中阳离子通过交换膜从负极区向正极区移动保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20mL 0.1mol·L-1MOH溶液中滴加0.1mol·L-1 CH3COOH溶液,所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是( )
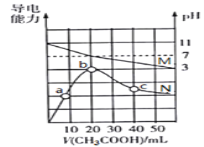
A. MOH是强碱
B. b点溶液中,c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有150mL的溶液,按要求回答下列问题:
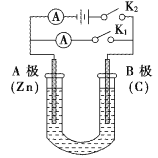
(1)打开K2,闭合K1,若所盛溶液为稀硫酸,则B极为___________极(填电极名称),该装置的能量转化形式为:__________,B极的电极反应式为:______________________。
(2)打开K1,闭合K2,若所盛溶液为NaCl溶液,一段时间后U形管内溶液的pH___________(填“变大”、“不变”或“变小”),总反应的化学方程式是:______________________。若要使U形管内溶液恢复到起始状态,应向U形管内的溶液加入(或通入)___________。
(3)如果要在铁块上镀上铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是___ (填“铁块”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会_____ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大
B. pH=14的溶液是碱性最强的溶液
C. 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol/L
D. 酸或碱溶液稀释时,溶液的pH均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
A. υ(A)=0.2mol/(L·min) B. υ(B)=0.9mol/(L·min)
C. υ(C)=0.5mol/(L·min) D. υ(D)=0.4mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com