
【题目】有关天然气、石油和煤的综合利用,下列说法错误的是
A.可燃冰是一种新型洁净能源B.石油裂化是为了提高轻质油的产量
C.煤的干馏属于物理变化D.以煤、石油、天然气为原料可生产三大合成材料
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
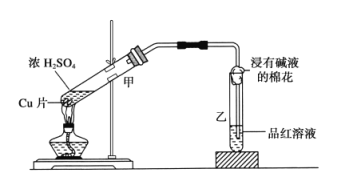
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. 混合溶液中,c(H+)=![]() mol·L-1 B. 混合溶液的pH=7
mol·L-1 B. 混合溶液的pH=7
C. a=b D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硝酸钙的工业废水常含有NH4NO3,可用电解法净化。其工作原理如图所示。下列有关说法正确的是

A. a极为电源负极,b极为电源正极
B. 装置工作时电子由b极流出,经导线、电解槽流入a极
C. Ⅰ室能得到副产品浓硝酸Ⅲ室能得到副产品浓氨水
D. 阴极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式如图所示:

⑴维生素C分子中—OH原子团的名称是__________________;维生素C__________________溶于水(填“易”或“难”),属于________________ 维生素(填“脂溶性”或“水溶性”)。
⑵维生素C又被称为抗坏血酸,它能促进胶原蛋白形成,所以能防治_____________
⑶一个人每天摄入约100mg维生素C就能满足需要,下列物质中含有丰富维生素C的是____
A.苦瓜 B.鸡蛋 C.豆腐 D.沙丁鱼
⑷“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话说明:维生素C具有_____________性(填“氧化性”或“还原性”);维生素C在这一反应中发生了_____________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-= 2AlO2-+OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法错误的是

A. 左装置 中Na+移向电极b
B. 电极c的电极反应式:CO(NH2)2-6e-+6OH-= CO2↑+N2↑+5H2O
C. 电解时,电子流动路径:Al极→导线→d极,c极→导线→b极
D. 通电2 min后,Al电极的质量减轻2.7 g,则产生H2的体积为3.36 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富硒食品倍受追捧是因为硒(Se)被誉为“生命的奇效元素”。硒与氧同主族,与钙同周期。下列关于硒的描述错误的是
A.原子序数为34B.氢化物的稳定性:H2Se>H2S.
C.原子半径:Ca>SeD.最高价含氧酸的酸性:H2SeO4<H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的符号:A__________,B__________,C__________,D__________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。
(4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。
(5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会新修订了阿伏加德罗常数(NA=6.02214076×1023mol1),并于2019年5月20日正式生效。下列有关NA说法正确的是
A. 22.4LCH2=CH2CH3分子中含碳碳双键的数目为NA
B. 17g羟基(﹣OH)所含的电子总数为9NA
C. 64 g S2和S8混合物中含硫原子总数为NA
D. 1L0.5mol·L1FeCl3溶液中Cl-数目小于1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com