
【题目】(1)已知2NO2(红棕色)![]() N2O4(无色)可以同时相互转化,①在密封有NO2的玻璃瓶中,升高温度,颜色加深,问NO2转化为N2O4是一个__________(填“吸热”或“放热”)反应;②在一个恒温恒压容器中,通入稀有气体。颜色_______(填“变深”、“变浅”或“不变”),平衡________移动(填“正向”、“逆向”或“不”下同);③在一个密闭恒容体系中,增大NO2的量,会引起NO2转化率________(填“增大”、“减小”或“不变”),颜色_______,再通入稀有气体增大压强,平衡________移动,颜色_________。
N2O4(无色)可以同时相互转化,①在密封有NO2的玻璃瓶中,升高温度,颜色加深,问NO2转化为N2O4是一个__________(填“吸热”或“放热”)反应;②在一个恒温恒压容器中,通入稀有气体。颜色_______(填“变深”、“变浅”或“不变”),平衡________移动(填“正向”、“逆向”或“不”下同);③在一个密闭恒容体系中,增大NO2的量,会引起NO2转化率________(填“增大”、“减小”或“不变”),颜色_______,再通入稀有气体增大压强,平衡________移动,颜色_________。
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
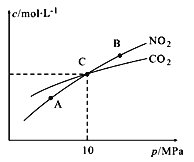
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②A、B、C三点中NO2的转化率最高的是_____(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】 放热 变浅 逆向 增大 变深 不 不变 = A 2
【解析】(1)①在密封有NO2的玻璃瓶中,升高温度,颜色加深,这说明平衡向逆反应方向进行,所以NO2转化为N2O4是一个放热反应;②在一个恒温恒压容器中,通入稀有气体,容器的容积一定增大,气体的浓度减小,所以颜色变浅,正反应体积减小,则平衡逆向移动;③在一个密闭恒容体系中,增大NO2的量,浓度增大,平衡向正反应方向进行,NO2转化率增大,但平衡后二氧化氮浓度仍然比原来大,因此颜色变深,再通入稀有气体增大压强,由于浓度不变,所以平衡不移动,颜色不变。
(2)①A、B两点温度相等,所以化学平衡常数相等;②由方程式可知正反应气体体积减小,增大压强,平衡逆向移动,NO2的转化率降低,A、B、C中A点压强最小,所以转化率最高;③设生成二氧化碳2x mol,则根据方程式可知:
2NO2(g)+2C(s)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol)1 0 0
转化量(mol)2x x 2x
平衡量(mol)1-2x x 2x
C点时NO2和CO2浓度相等,则1-2x=2x,解得:x=0.25,由于C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2),Kp(C)=Kp2(CO2)Kp(N2)/Kp2(NO2)=Kp(N2)=10MPa×0.25/(0.5+0.25+0.5)=2MPa。


科目:高中化学 来源: 题型:
【题目】按要求填写下列空格
(1)同温同压下,有0.3molO2与0.2molO3 , 它们的质量之比为 , 它们所含的原子数之比为 , 它们的体积之比为 , 它们的密度之比为 .
(2)由 ![]() H和
H和 ![]() O构成的水摩尔质量为 , 10g该水分子的物质的量为 , 含中子mol.
O构成的水摩尔质量为 , 10g该水分子的物质的量为 , 含中子mol.
(3)实验室需要0.1molL﹣1 NaOH溶液480mL.根据溶液的配制情况回答下列问题:根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度0.1molL﹣1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度0.1molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡状态I、II、III的相关数据如下表:
编号 | 化学方程式 | 平衡常数 | 温度 | |
979K | 1173K | |||
I | Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
Ⅱ | CO(g)+H2O(g) | K2 | 1.62 | b |
Ⅲ | Fe(s)+H2O(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是
A.a>b
B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动
D.反应II、III均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含有Ca2+、Mg2+及SO ![]() ,除去杂质离子所加入的试剂及顺序可以是:试剂①NaOH、试剂②、试剂③、试剂④ . 在加试剂③后,应先进行一个实验操作之后再加入试剂④.
,除去杂质离子所加入的试剂及顺序可以是:试剂①NaOH、试剂②、试剂③、试剂④ . 在加试剂③后,应先进行一个实验操作之后再加入试剂④.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式 CO ![]() +2H+=CO2↑+H2O表示的反应是( )
+2H+=CO2↑+H2O表示的反应是( )
A.Na2CO3+2HCl═2NaCl+CO2↑+H2O
B.NaHCO3+HCl═NaCl+CO2↑+H2O
C.K2CO3+2CH3COOH═2CH3COOK+CO2↑+H2O
D.CaCO3+2HNO3═Ca(NO3)2+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应逆反应的△H_____0(填“<”“>”“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。则6s时c(A)=_____________,C的物质的量为_____________;若反应经一段时间后,达到平衡时A的转化率为_______________,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ___________________。
(3)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为____________。
A(g)+B(g)的平衡常数的值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学与自然的开发利用描述中不正确的是
A. 可用热分解法冶炼氧化汞得到水银
B. 从自然界中提炼金属要经过矿石的富集、冶炼、精炼三步
C. 铝热法炼铁的反应需要高温的条件,所以是吸热反应
D. 金属单质被发现和应用得越早,其活动性一般越弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 含有共价键的化合物一定是共价化合物
B. 气态单质分子中一定存在共价键
C. 含有离子键的化合物一定是离子化合物
D. 含有离子键的化合物不一定是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com