
【题目】下表为元素周期表的一部分, 回答下列问题。
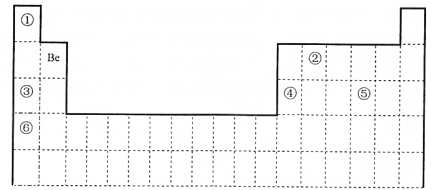
(1)我国科学家采用“铝铍测年法”测量“北京人”年龄。10Be 和9Be______________
a.是同一种核素 b.具有相同的中子数 c.互为同素异形体 d.互为同位素
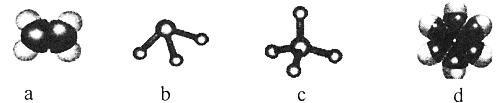
(2)元素①和②可形成多种化合物。下列模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(3)元素①~⑥中,金属性最强的是___(填元素符号)。②的单质和⑤的最高价氧化物对应水化物的浓溶液反应的化学方程式为______________。
(4)碘(53I) 是人体必需的微量元素之一。
①碘(53I) 在周期表中的位置是______
②CI-、Br-、I-的还原性由大到小的顺序为_______。
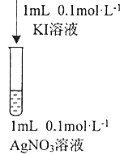
③资料显示: Ag+和I-会发生氧化还原反应生成两种单质,反应的离子方程式为_______。某同学用图实验验证上述反应,观察到两溶液混合后立即出现黄色浑浊,再加入淀粉溶液,不变蓝。分析产生上述现象的可能原因:________________
【答案】d b K
C+2H2SO4(浓)![]() CO2↑+ 2SO2↑+2H2O 第五周期ⅦA (或第5周期ⅦA) I->Br->Cl- 2Ag++2I-=2Ag↓+I2 Ag+和I-发生氧化还原反应的速率慢于发生沉淀反应的速率。物质的氧化性、还原性受浓度或温度影响,溶液中离子浓度较小或温度不够,氧化还原反应不易发生
CO2↑+ 2SO2↑+2H2O 第五周期ⅦA (或第5周期ⅦA) I->Br->Cl- 2Ag++2I-=2Ag↓+I2 Ag+和I-发生氧化还原反应的速率慢于发生沉淀反应的速率。物质的氧化性、还原性受浓度或温度影响,溶液中离子浓度较小或温度不够,氧化还原反应不易发生
【解析】
质子数相同,中子数不同的一类原子互称为同位素;根据元素在周期表中的位置可知,①为H元素,②为C元素,③为Na元素,④为Al元素,⑤为S元素,⑥为K元素。
(1) 10Be和9Be的质子数相同,但中子数不同,故两者互为同位素。
(2)元素①为H和②为C,两者形成分子时,C原子能形成4条共价键,H原子形成1条共价键。a为乙烯,c为甲烷,d为苯,均由C、H组成; 但c分子的中心原子形成3条键,不符合碳的四价键原子,故不是由C、H元素形成的。
(3)同周期从左到右,同主族从上到下,元素金属性越来越强,故元素①~⑥中,金属性最强的是K。②的单质为C,⑤的最高价氧化物对应水化物的浓溶液为浓硫酸,碳与浓硫酸反应生成二氧化硫、二氧化碳和水,反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(4)①碘(53I)在周期表中的位置是第五周期ⅦA (或第5周期ⅦA)。
②同主族从上到下,相应阴离子的还原性越来越强,故CI-、Br-、I-的还原性由大到小的顺序为I->Br->Cl-。
③Ag+和I-会发生氧化还原反应生成两种单质,这两种单质为银和碘,故反应的离子方程式为2Ag++2I-=2Ag↓+I2;碘化钾溶液和硝酸银溶液混合后立即出现黄色浑浊,再加入淀粉溶液,不变蓝,则银离子与碘离子反应生成碘化银,原因可能为Ag+和I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性、还原性受浓度或温度影响,溶液中离子浓度较小或温度不够,氧化还原反应不易发生。


科目:高中化学 来源: 题型:
【题目】标况下把V体积氨气溶于1体积水中得到氨的饱和溶液,试完成下列填空。
(1)NH3通入水中发生的反应为____________________。
(2)氨水中存在的分子有__________________________。
(3)氨水中存在的离子有__________________________。
(4)所得氨水的质量分数为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸”电池原理如图所示,(电解质溶液为含C2O![]() 的盐溶液,电池总反应为2A1+ 6CO2=Al2(C2O4)3,下列有关说法正确的是
的盐溶液,电池总反应为2A1+ 6CO2=Al2(C2O4)3,下列有关说法正确的是

A.Al作负极B.C2O![]() 由负极迁移至正极
由负极迁移至正极
C.该装置将电能转变为化学能D.每生成1 mol Al2(C2O4)3,需要消耗134.4L的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验装置图回答(装置用代号表示)

①实验室制用高锰酸钾制氧气时,应选用的发生装置是_____;制氢气时应选用的发生装置是_____,制二氧化碳时应选用的发生装置是_____,检验二氧化碳气体可选用D装置,其装置中盛放的试剂一般是_______。
②用锌粒和浓盐酸反应制氢气,将制成的气体通入硝酸银,有白色沉淀,说明氢气中含有(写化学式)_____,反应方程式为______,若要制出纯净的氢气,除发生装置外还应选用的一种装置是_____;该装置中药品的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是四种原子序数依次增大的短周期元素,W 的最外层电子数比 X 的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2 的结构式如图所示。下列说法错误的是
![]()
A.化合物 WY 是良好的耐热冲击材料
B.Y的氧化物对应的水化物可能是弱酸
C.Y的简单氢化物的沸点一定高于 Z
D.化合物(ZXY)2 中所有原子均满足 8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1) Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3) Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,易溶于乙醚,其晶体类型为______,
(4) 科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为______________________。
(5) FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρ g/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
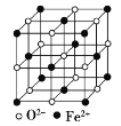
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1)![]() 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁![]() Ⅲ
Ⅲ![]() ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中![]() 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___![]() 碳原子为____杂化,
碳原子为____杂化,![]() 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中![]() 键
键![]() 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇![]() 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇![]() 属于____晶体.
属于____晶体.![]() 存在的化学键有_____
存在的化学键有_____![]() 填字母
填字母![]() .
.
A.离子键 ![]() 极性键
极性键 ![]() 非极性键
非极性键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 金属键
金属键
(4)已知: ,反应后,
,反应后,![]() 键_____,
键_____,![]() 键_____
键_____![]() 填“增加”或“减少”
填“增加”或“减少”![]() .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”,可表示成
键”,可表示成![]() ,则
,则![]()
![]() 咪唑
咪唑![]() 中的“离域
中的“离域![]() 键”可表示为_________
键”可表示为_________
(6)奥氏体是碳溶解在![]() 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为![]() ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() .
.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数。下列说法正确的是( )
①在标准状况下,NA个SO3分子所占的体积为22.4L
②S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
③标准状祝下,22.4LNO和11.2LO2混合后气体的分子总数为1.5 NA
④1molAlCl3溶于1L的水中,所得溶液含有1NAAl3+
⑤在标准状况下,22.4LCl2与足量的氢氧化钾溶液反应转移的电子数为NA
⑥100mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是0.5NA
A.②⑤ B.①②④⑥ C.③⑤⑥ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为mg的铜屑完全溶于适量浓硝酸中,反应后得到NO2、NO的混合气体,将所得气体通入300mL2molL-1NaOH溶液中,恰好完全反应,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为0.2mol,则m的值为( )
A.12.8B.19.2C.25.6D.51.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com