
【题目】已知A是灰黑色、有金属光泽的固体单质。根据如图所示的物质之间的转化关系,回答下列有关问题。
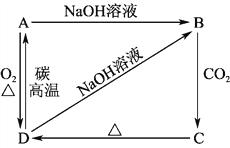
(1)写出A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出D→A的化学方程式:__________________________________________。
(3)写出下列反应的离子方程式。
B→C:____________________________________;
D→B:____________________________________。
【答案】 Si Na2SiO3 H2SiO3 SiO2 SiO2+2C![]() Si+2CO↑ SiO
Si+2CO↑ SiO![]() +CO2+H2O===H2SiO3↓+CO
+CO2+H2O===H2SiO3↓+CO![]() SiO2+2OH-===SiO
SiO2+2OH-===SiO![]() +H2O
+H2O
【解析】本题无机推断,(1)A是灰黑色,且A是有金属光泽的固体单质,因此A为Si,根据转化关系,B为Na2SiO3、C为H2SiO3、D为SiO2;(2)D→A,利用SiO2与C的反应,即SiO2+2C![]() Si+2CO↑;(3)B→C:利用碳酸的酸性强于硅酸,离子反应方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,D→B:SiO2属于酸性氧化物,离子反应方程式为SiO2+2OH-=SiO32-+H2O。
Si+2CO↑;(3)B→C:利用碳酸的酸性强于硅酸,离子反应方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,D→B:SiO2属于酸性氧化物,离子反应方程式为SiO2+2OH-=SiO32-+H2O。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+BmC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问: 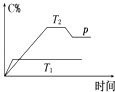
(1)温度T1T2(填“大于”“等于”或“小于”).
(2)正反应是反应(填“吸热”或“放热”).
(3)如果A、B、C均为气体,则m2(填“大于”“等于”或“小于”).
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强(填“增大”“减小”或“不变”),平衡移动(填“向正反应方向”“向逆反应方向”或“不”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图与表述一致的是( )
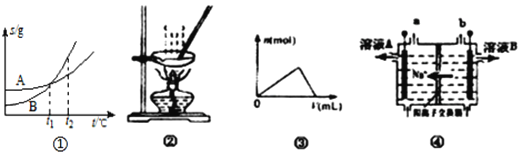
A. 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A
B. 用图②所示装置蒸发FeCl3溶液制备无水FeCl3
C. 图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D. 图④电解饱和食盐水的装置中,溶液B为浓氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
A.O2和O3互为同位素
B.O2转化为O3为化学变化
C.相同物质的量的O2和O3的体积相同
D.相同质量的O2和O3含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( )
A.Na+、Ba2+、Cl-、SO42-B.Na+、CO32-、Cl-、K+
C.Mg2+、Ag+、NO3-、Cl-D.H+、Cl-、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
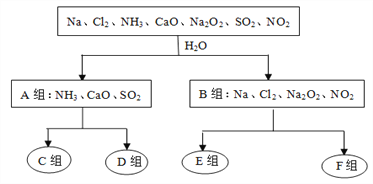
水溶液呈酸性 水溶液呈碱性 水作氧化剂 水既不作氧化剂也不作还原剂
(1)根据物质与水反应的情况,分成A、B组的分类依据是______________________________;
(2)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类别为____(填序号);
①金属氧化物 ②酸性氧化物 ③碱性氧化物 ④两性氧化物
(3)D组中的气体水溶液呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因:________________________________________________________________________________;
(4)F组中与水反应氧化剂与还原剂的之比是1:1的物质是______________(填化学式);
(5)SO2是形成酸雨的主要污染物,目前有一种较为有效的方法是在高空喷洒一种粉末状物质X,脱硫效果可达85%,其反应的化学方程式为:2X+2SO2+O2===2CaSO4+2CO2,由此可知X的化学式是_________;
(6)Cl2、Na2O2、SO2都能使品红褪色,其中漂白原理与其它两种物质不同的是_______________;将等物质的量的SO2、Cl2同时通入品红溶液中,实验现象是_________________________,产生该现象的原因是____________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是
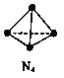
A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( ) 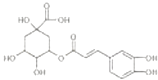
A.绿原酸分子中有4个手性碳原子
B.绿原酸能发生显色反应、取代反应和加成反应
C.每摩尔绿原酸最多与4 mol NaOH反应
D.绿原酸分子中所有碳原子都能在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com