
【题目】在如图所示的量热计中,将100mL![]() 溶液与
溶液与![]() 溶液混合,温度从
溶液混合,温度从![]() 升高到
升高到![]() 已知量热计的热容常数
已知量热计的热容常数![]() 量热计各部件每升高
量热计各部件每升高![]() 所需的热量
所需的热量![]() 是
是![]() 生成溶液的比热容为
生成溶液的比热容为![]() ,溶液的密度均近似为
,溶液的密度均近似为![]() .
.
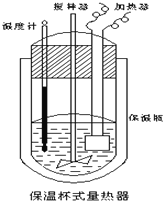
(1)试求![]() 的中和热
的中和热![]() ______.
______.
(2)![]() 的中和热的文献值为
的中和热的文献值为![]() ,则请你分析在
,则请你分析在![]() 中测得的实验值偏差可能的原因______.
中测得的实验值偏差可能的原因______.
(3)实验中NaOH过量的目的是______.
【答案】-53.3kJ/mol ①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等 使碱稍稍过量,为了能保证CH3 COOH溶液完全被中和,从而提高实验的准确度
【解析】
(1)根据化学反应热的计算公式Q=-cm△T来计算;
(2)根据中和热的测定中能够导致放出的热量偏低的因素进行解答;
(3)为了确保CH3COOH溶液完全被中和,从而提高实验的准确度,所用NaOH稍过量.
![]() 温度从
温度从![]() 升高到
升高到![]() ,
,![]() ,
,![]() 的中和热
的中和热![]() ,
,
故答案为:![]() ;
;
![]() 的中和热的文献值为
的中和热的文献值为![]() ,实际上测定数值偏低,可能原因有:
,实际上测定数值偏低,可能原因有:![]() 量热计的保温瓶效果不好,
量热计的保温瓶效果不好,![]() 酸碱溶液混合不迅速,
酸碱溶液混合不迅速,![]() 温度计不够精确等,
温度计不够精确等,
故答案为:![]() 量热计的保温瓶绝热效果不好;
量热计的保温瓶绝热效果不好;![]() 酸碱溶液混合不迅速;
酸碱溶液混合不迅速;![]() 温度计不够精确等;
温度计不够精确等;
![]() 酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证
酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证![]() 溶液完全被中和,从而提高实验的准确度,
溶液完全被中和,从而提高实验的准确度,
故答案为:使碱稍稍过量,为了能保证![]() 溶液完全被中和,从而提高实验的准确度;
溶液完全被中和,从而提高实验的准确度;


科目:高中化学 来源: 题型:
【题目】缩醛是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。G可以由如图途径合成:

已知:I.A的分子式为C7H8,属于芳香烃;D的产量可以用来衡量一个国家石油化工发展水平;
Ⅱ.缩醛化反应原理:

Ⅲ.同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)F的名称为______________________。
(2)写出由A生成B的化学方程式:______________________。
(3)反应①的条件为___________;反应②的反应类型为___________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉效率高、污染物少的优点,维生素C的结构简式为 。则维生素C分子中含氧官能团的名称为___________、___________。
。则维生素C分子中含氧官能团的名称为___________、___________。
(5)缩醛G的结构简式为___________。同时满足下列条件的G的同分异构体有___________种(不考虑立体异构);其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为______________________。
①苯环上只有两个取代基
②既能发生银镜反应,又能与FeCl3溶液发生显色反应
(6)D的一种含4个碳原子的无支链同系物H,所有碳原子一定在同一平面上。H作为原料可用于制取目前产量居第二位的顺丁橡胶。试写出该合成路线(其他试剂任选):______________________ ![]() 顺丁橡胶。
顺丁橡胶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.海产品可用福尔马林浸泡防腐保鲜
C.煤经过气化一液化等物理变化可以转化为清洁燃料
D.粮食酿酒经过了淀粉![]() 葡萄糖
葡萄糖![]() 乙醇的化学变化过程
乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
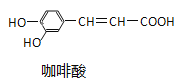
【题目】绿原酸是一种有降压作用的药物,可由咖啡酸![]() 一种芳香酸
一种芳香酸![]() 与奎尼酸通过酯化反应合成。下列说法正确的是
与奎尼酸通过酯化反应合成。下列说法正确的是![]()
![]()
 、
、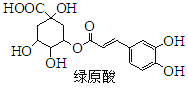
A.奎尼酸分子式为![]()
B.绿原酸能发生取代、加成、消去反应
C.1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH
D.咖啡酸和奎尼酸都能与![]() 溶液发生显色反应
溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精,诺卜醇的一种制备方法如图所示。下列说法正确的是( )
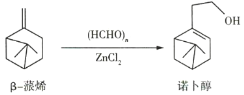
A.可用溴的![]() 溶液区别β-蒎烯与诺卜醇
溶液区别β-蒎烯与诺卜醇
B.β-蒎烯的饱和碳原子上的一氯代物最多有7种
C.β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D.可用酸性高锰酸钾溶液鉴别β-蒎烯和诺卜醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)![]() O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
A. 戴维法制钠,阳极的电极反应式为:Na++e-=Na↑
B. 盖·吕萨克法制钠原理是利用铁的金属性比钠的强
C. 若用戴维法与盖·吕萨克法制得等量的钠,两方法转移电子总数相等
D. 还可以用电解熔融氯化钠法制钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关概念或原理的叙述正确的是 ( )
A.氨基酸、蛋白质和氧化铝一样既能与酸反应,又能与碱反应,所以它们都是两性氧化物
B.制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是![]()
C.乙烯和聚乙烯都能使酸性![]() 溶液褪色
溶液褪色
D.甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是,它们既可以发生水解反应,又可以发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市售一次性电池品种很多的,碱性锌锰电池的日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
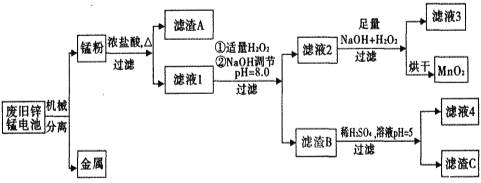
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含量有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表。
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH (c≤1.0x10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___。计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=___。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式___。
(3)写出滤渣B与稀硫酸在pH=5时的化学方程式___。
(4)工艺中还可以将滤液4进行___、___、___、___、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4,在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com