
| A、第三周期元素从Na到Cl原子半径逐渐减小 |
| B、过渡元素全是金属元素,可用于寻找优良催化剂 |
| C、同一主族元素的单质,从上到下化学性质越来越活泼 |
| D、第三周期主族元素的最高正化合价数等于它所处的族序数 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物 |
| B、在H2O跟ICl的反应中,ICl是氧化剂H2O是还原剂 |
| C、在Zn跟ICl的反应中,ZnCl2既是氧化产物又是还原产物 |
| D、在H2O跟ICl的反应中,ICl既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
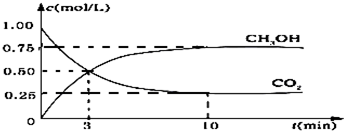
| n(CH3OH) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
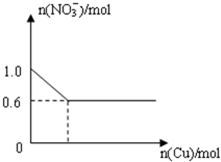 将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com