
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
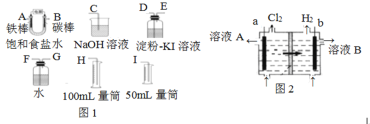
(1)试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接______,B接______。
(2)碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为____。
(5)工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是__(填“阳离子”或“阴离子”)交换膜,溶液A是_______(填溶质的化学式)
【答案】G、F、I D、E、C 2Cl--2e-=Cl2↑ 淀粉-KI溶液变成蓝色 12 阳离子 NaOH
【解析】
(1)实验的目的是电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性,结合装置的作用来连接装置;
(2)实验目的生成氢气和氯气,所以铁应为阴极,碳棒为阳极;
(3)氯气具有氧化性,能氧化碘离子生成碘单质,使淀粉碘化钾溶液变蓝色说明;
(4)电解饱和食盐水的方程式:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,利用公式c=
2NaOH+H2↑+Cl2↑,利用公式c=![]() 来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH;
来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH;
(5)氢气在阴极生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过;a极上氯离子失电子,生成氯气同时溶液中生成NaOH。
(1)产生的氢气的体积用排水量气法,预计H2的体积6ml左右,所以选I不选H,导管是短进长出,所以A接G,用装有淀粉碘化钾溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,即E接C;
(2)实验目的生成氢气和氯气,所以铁应为阴极,连接电源负极,碳棒为阳极,所以炭棒接直流电源的正极,电极反应:2Cl--2e-═Cl2↑;
(3)氯气具有氧化性,能氧化碘离子生成碘单质,碘单质遇到淀粉变蓝色,使淀粉碘化钾溶液变蓝色说明氯气具有氧化性;
(4)因电解饱和食盐水的方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,当产生的H2的体积为5.6mL时,物质的量n=
2NaOH+H2↑+Cl2↑,当产生的H2的体积为5.6mL时,物质的量n=![]() =2.5×10-4mol,生成氢氧化钠的物质的量为5×10-4mol,所以溶液中NaOH的物质的量浓度=
=2.5×10-4mol,生成氢氧化钠的物质的量为5×10-4mol,所以溶液中NaOH的物质的量浓度=![]() ═0.01mol/L,所以氢离子的浓度=
═0.01mol/L,所以氢离子的浓度=![]() mol/L=1×10-12mol/L,pH=12;
mol/L=1×10-12mol/L,pH=12;
(5)氢气在阴极生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过,所以离子交换膜为阳离子交换膜;a极上氯离子失电子,生成氯气同时溶液中生成NaOH,所以溶液A是NaOH。


科目:高中化学 来源: 题型:
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是
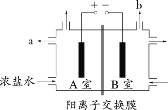
A.粗盐水中含有的少量 Ca2+和 Mg2+均可用 NaOH 除去
B.若电路中通过 0.2 mol 电子,理论上可在 b 处得到标准状况下 1.12 L 气体
C.a 处得到的是浓 NaOH 溶液
D.适当降低阳极电解液的 pH 有利于 Cl2 逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)为探究实验室制取氢气的合适条件,探究学习小组用如图所示装置制取氢气。

①仪器b的名称是___,若用锌粒和3molL-1H2SO4制取氢气可选用上述仪器中的___(填字母序号)组成氢气的制备和收集装置。
②实验测得H2的生成速率如图2所示:
根据t1~t2时间速率变化判断该反应是___反应(填“吸热”或“放热”)。t2~t3时间速率变化的主要原因是___。
③若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是___。
(2)已知:化学键的键能是指气态原子间形成1mol化学键时释放的能量。几种化学键的键能如下表所示:
键能(kJmol-1) | |
H-H | 436 |
S=S | 255 |
H-S | 339 |
1molS2(g)与足量H2完全反应生成H2S,放出___kJ的热量。
(3)以H2为原料设计成氢氧燃料电池,电池的构造如图3所示,下列说法正确的是___(在原电池中发生氧化反应的电极称为负极)。
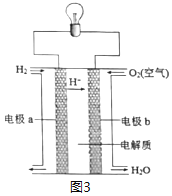
A.电极b是该电池的正极 B.该电池的能量转化率可达100%
C.可用蔗糖溶液作电解质溶液 D.供电时的总反应为:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电能力越强,电导率越大。常温下用0.1000 mol/L盐酸分别滴定10.00 mL浓度均为0.1000 mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,已知在常温下Kb[(CH3)2NH·H2O]=1.6×10-4),利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
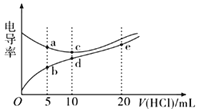
A.盐酸滴定二甲胺实验中选择酚酞做指示剂比选甲基橙误差更小
B.d点溶液中:c(H+)<c(OH-)+c[(CH3)2NH2+]
C.a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+]<c[(CH3)2NH·H2O]
D.b、c、e三点的溶液中,水的电离程度最大的是e点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知1mol石墨转化为1mol金刚石要吸收能量,则1mol石墨的能量比1mol金刚石的能量___(填“高”或“低”),石墨比金刚石___(填“稳定”或“不稳定”)。
(2)Ba(OH)28H2O和NH4Cl反应的化学方程式是___,该反应是 ___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合___(填“图1”或“图2”)。

(3)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种无色有刺激性气味的液体,在生活中有重要用途,同时也是一种重要的化工原料。
(1)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH溶液(电解质溶液)构成,则下列说法正确的是___。
(已知甲醇在空气中燃烧生成CO2和H2O)
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
(2)写出甲醇燃料电池在酸性条件下负极的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如下:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)

(1)把NaCl和AlCl3的固体混合物置于下图所示的装置的一端,加热到_______(最低温度)℃,即可分离NaCl和AlCl3
![]()
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有_______;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是_______
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:
①H++OH![]() H2O,
H2O,
②________
(4)镀铝电镀池中,金属铝为____极,熔融盐电镀池中存在Na+K+AlCl4-Al2Cl7-等离子钢材表面(电极)的电极反应式为AlCl4-+3e-![]() Al+4Cl-或_________
Al+4Cl-或_________
(5)钢材镀铝后,在表面氧化成致密的_____________,避免钢材接触空气而防止钢材被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是 ( )
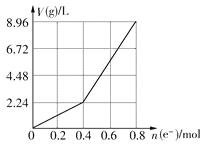
A.电解前CuSO4溶液的物质的量浓度为2 mol/L
B.电解后所得溶液中c(H+)=2 mol/L
C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3
D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com