
【题目】一真空密恒容闭容器中盛有1mol PCl5,加热到200℃时发生反应:PCl5(g)![]() PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
A.M>NB.M<NC.M=ND.无法确定
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】苯甲酸苯甲酯(![]() )可以用作香料、食品添加剂及一些香料的溶剂,可通过如下方法合成(部分反应的条件已略去)。
)可以用作香料、食品添加剂及一些香料的溶剂,可通过如下方法合成(部分反应的条件已略去)。
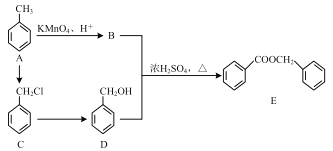
(1)B 的结构简式是 ______ 。
(2)A→C 反应类型是_______。
(3)B、D 中官能团的名称分别是 ____ 、_______。
(4)写出 B+D→E 的反应方程式 _______。
(5)实现由![]() 合成
合成![]() 的流程如下,请你以流程图第一步转化作为示例,将下面流程中所缺部分的反应条件与中间产物补充完整。
的流程如下,请你以流程图第一步转化作为示例,将下面流程中所缺部分的反应条件与中间产物补充完整。
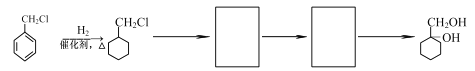 ____________
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试
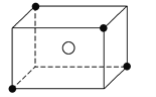
(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物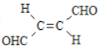 ,下列叙述正确的有( )
,下列叙述正确的有( )
A.分子间可形成氢键B.分子中既有极性键又有非极性键
C.分子中有7个![]() 键和1个
键和1个![]() 键D.C原子的杂化方式是sp2和sp3
键D.C原子的杂化方式是sp2和sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下以下结论错误的是( )
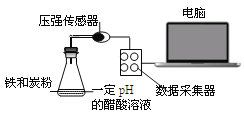
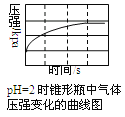
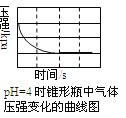
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁不可能发生吸氧腐蚀
C.吸氧腐蚀的速率比析氢腐蚀快
D.两溶液中负极反应均为:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnCl4是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,下图采用微型实验进行SnCl4 的制备,解决了常规方法的弊端(己知:SnCl4的熔点为-33℃,沸点为114.1℃)。
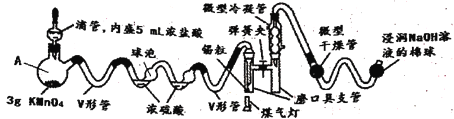
(1)将已干燥的各部分仪器按图连接好后,需要进行的操作为________________________。
(2)V形管的作用是________________________________________________________。
(3)下列说法中正确的是_____
A.仪器A的名称为蒸馏烧瓶
B.为了充分干燥氯气,浓硫酸的体积应大于球泡的体积
C.操作时应先滴加浓盐酸,使整套装置内充满黄绿色气体,再用煤气灯加热
D.生成的SnCl4蒸气经冷却聚集在磨口具支管中
E.微型干燥管中的试剂可以是碱石灰、五氧化二磷或无水氯化钙等
(4)实验中0.59锡粒完全反应制得1.03g SnCl4,则该实验的产率为_____________(计算结果保留一位小数)。
(5)SnCl4遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为_______________。
(6)该微型实验的优点是________________________________________________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是
A. 装置用于测定生成氢气的速率
装置用于测定生成氢气的速率
B. 装置依据单位时间内颜色变化来比较浓度对反应速率的影响
装置依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置依据 U 型管两边液面的高低判断钠和水反应的热效应
装置依据 U 型管两边液面的高低判断钠和水反应的热效应
D. 装置依据出现浑浊的快慢比较温度对反应速率的影响
装置依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的碳酸钙与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如下图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 | 对应曲线 | c(HCl) / mol·L-1 | 反应温度 / ℃ | 铁的状态 | |
1 | a | 30 | 粉末状 | ||
2 | b | 30 | 粉末状 | ||
3 | c | 2.5 | 块状 | ||
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢
B. 第1组实验中盐酸的浓度可能最大
C. 第2组实验中盐酸浓度可能等于2.5mol/L
D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com